DE hydrolys konstant (Kh) avser a kemisk balans upprättas från hydrolys av ett salt (kemisk reaktion som involverar ett lösligt salt och vatten).
Som konstanten för alla andra jämvikter, uttrycket av hydrolys konstant konstrueras från produkten av produktkoncentrationer dividerad med produkten av reagenskoncentrationer, enligt följande:
Kh = [Produkter]
[reagenser]
Att arbeta med hydrolyskonstanten innefattar kunskap om tre viktiga fenomen:
- Dissociation av salter;
- Vattenjonisering;
- Salthydrolys.
Dissociation av salter
När ett lösligt salt tillsätts till vatten, dissocierar det och frigör en annan katjon än hydronium (H +) och annan anjon än hydroxyl (OH-).

För att påminna dig om ett salt är eller inte är lösligt i vatten, Klicka här och studera saltlöslighetstabellen.
vattenjonisering
Vatten är ett ämne som naturligt genomgår fenomenet självjonisering, det vill säga det producerar en hydroniumkatjon och en hydroxylanjon.
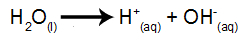
vattenjonisering ekvation
hydrolys av ett salt
Som ett lösligt salt släpper det ut joner i vattnet och vattnet genomgår jonisering och producerar
joner i mitten kan reaktionen (hydrolys) mellan saltjonerna och vattenjonerna äga rum. När denna reaktion inträffar är de möjliga interaktionerna:- Katjon av saltet med anjonen av vatten (bildning av en bas);
- Saltjon med katjon av vatten (bildande av salt);
Ovanstående interaktioner kommer endast att ske om basen eller syran som bildas är svag.
Se ett exempel på hydrolys av ett salt:
→ Hydrolys av ammoniumhypoklorit (NH4ClO)
När ammoniumhypoklorit tillsätts till vatten upplöses och dissocieras och frigör ammoniumkatjonjoner (NH4 +) och hypokloritanjonen (ClO-):

Ekvation som visar jonerna som frigörs vid dissociationen av ammoniumhypoklorit
Eftersom vatten, när det genomgår jonisering, producerar H + och OH-, har vi i lösningen två katjoner och två anjoner, som kan reagera. NH4 + -katjonen reagerar endast med OH-anjonen eftersom den bildar en svag bas (NH4OH). ClO-anjonen reagerar bara med H + -katjonen eftersom den bildar en svag syra (HClO).

Ammoniumhypoklorithydrolysjämviktsekvation
Konstruktion av uttrycket av hydrolyskonstanten
Konstruktionen av hydrolyskonstanten för ett salt beror uteslutande på hydrolysekvationen för det saltet. Hydrolysen av ammoniumhypoklorit, till exempel, arbetade med i föregående artikel genererade följande ekvation:

Ammoniumhypoklorithydrolysjämviktsekvation
Hur man bygger uttrycket för hydrolys konstant tar hänsyn till produkter och reagenser skulle uttrycket för konstanten vara:
Kh = [HClO]. [NH4OH]
[ClO -]. [NH4 +]
OBS: Vatten deltar inte i ekvationen eftersom det är ett flytande reagens och också för att det är det grundläggande sättet för förekomst av hydrolys, det vill säga det är konstant.
Av mig Diogo Lopes Dias
Källa: Brazil School - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-constante-hidrolise.htm