Atom är namnet på materiens formare (allt som upptar utrymme och har massa). Detta namn föreslogs av de grekiska filosoferna Democritus och Leucippus. Kemiska element, molekyler, ämnen och organiska eller oorganiska material bildas av atomer.
I sin konstitution har atomen partiklar (protoner, neutroner och elektroner), som inte är den minsta delen av materien. Fortfarande, din visualisering är inte möjlig. Vad som är känt om atomen är relaterat till vetenskapligt bevisade fysiska, kemiska och matematiska aspekter.
Utvecklingen av kunskap om atomen har fått flera tekniker att utvecklas och förbättras.
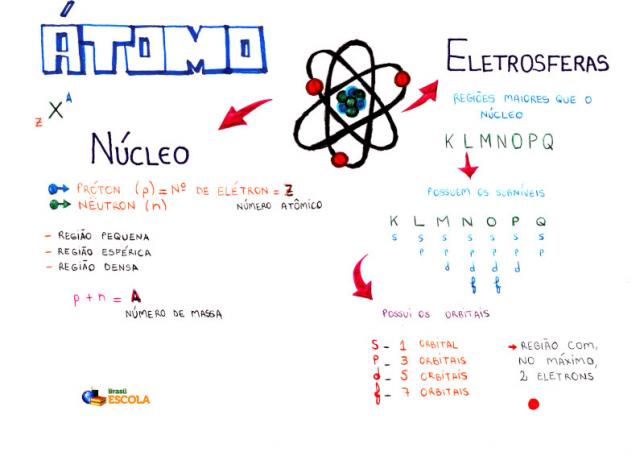
Grundläggande sammansättning av en atom
Kärna: tätare område av atomen och håller protoner och neutroner;
Energinivåer: regioner som omger kärnan och som rymmer undernivåer, orbitaler och elektroner. Det finns sju energinivåer som representeras av bokstäverna K, L, M, N, O, P och Q;
Undernivåer för energi: är regioner som rymmer orbitalerna. De finns på alla nivåer och representeras av bokstäver (s, p, d f). Mängden beror på varje nivå: K (har s undernivåer), L (har s och p undernivåer), M (har s, p och d undernivåer), N (har undernivåer s, p, d och f), O (har undernivåer s, p, d och f), P (har undernivåer s, p och d) och Q (har undernivåer s och P);
Atomiska orbitaler: regioner som mest sannolikt hittar en elektron. Varje delnivå har olika antal orbitaler: s (en orbital), p (tre orbitaler), d (fem orbitaler) och f (sju orbitaler);
protoner: positiva partiklar (representerade av p);
elektroner: negativa partiklar som också har vågbeteende (representerat av e);
neutroner: oladdade partiklar som minskar avstötningen mellan protoner i kärnan (representerad av n).
Mind Map: Atom
* För att ladda ner mind map i PDF, Klicka här!
representation av en atom
Det enklaste sättet att representera en atom är att använda förkortningen för det kemiska grundämnet den bildar. Akronymen Se representerar till exempel alla atomer som bildar det kemiska grundämnet selen.
Förkortningen som representerar atomen kan fortfarande ge två viktiga informationsstycken: atomnumret (representerat av bokstaven Z och alltid på vänster sida botten av atomens akronym) och massnumret (representerat av bokstaven A, som kan placeras på vänster eller höger sida högst upp på atomens akronym atom).
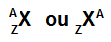
Akronym för en atom med massnummer och atomnummer
atomnummer (Z): anger antalet protoner som finns i atomens kärna och antalet elektroner (e) som finns i energinivåerna.
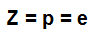
Formel som anger atomnummerets representativitet
Massnummer (A): indikerar massan som finns i atomens kärna, vilket är resultatet av summan av antalet protoner (p) och antalet neutroner (n).

Formel som anger massnummerets representativitet
Atomiska likheter
Atomer av samma kemiska grundämne eller olika kemiska element kan jämföras i termer av antalet protoner, elektroner, neutroner och massa och klassificeras enligt följande:
a) Isotoper
De är atomer som har:
samma atomnummer;
samma antal protoner;
olika massnummer;
olika antal neutroner;
Exempel:
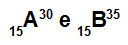
Atomerna A och B är isotoper
Atomer A och B är isotoper eftersom:
Atom A har 15 protoner, atomnummer lika med 15, 15 elektroner, 15 neutroner och massantal lika med 30.
Atom B har 15 protoner, atomnummer lika med 15, 15 elektroner, 20 neutroner och massantal lika med 35.
b) Isobar
De är atomer som har:
olika atomnummer;
olika antal protoner;
olika antal elektroner;
samma massnummer;
olika antal neutroner.
Exempel:
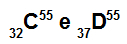
Atomerna C och D är isobar
Atomerna C och D är isobära eftersom:
Atom C har 32 protoner, atomnummer lika med 32, 32 elektroner, 23 neutroner och massantal lika med 55.
Atom D har 37 protoner, atomnummer lika med 37, 37 elektroner, 18 neutroner och massantal lika med 55.
c) Isotoner
De är atomer som har:
olika atomnummer;
olika antal protoner;
olika antal elektroner;
olika massnummer;
samma antal neutroner.
Exempel:
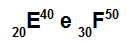
Atomer E och F är isotoper
Atomer E och F är isotoper eftersom:
Atom E har 20 protoner, atomnummer lika med 20, 20 elektroner, 20 neutroner och massantal lika med 40.
Atom F har 30 protoner, atomnummer lika med 30, 30 elektroner, 20 neutroner och massantal lika med 50.
d) Isoelektronik
De är atomer som har:
samma antal elektroner.
NOTERA: isoelektroniska atomer kan också ha samma massnummer (isobar), samma antal neutroner (isotoner) eller samma antal protoner (isotoper).
Exempel:
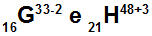
Atomerna G och H är isoelektroniska
Atomerna G och H är isoelektroniska eftersom:
Atom G har 16 protoner, atomnummer lika med 16, 18 elektroner (tecknet -2 indikerar att det har två fler elektroner än antalet protoner), 17 neutroner och massantal lika med 33.
Atom H har 21 protoner, atomnummer lika med 21, 18 elektroner (+3-tecknet indikerar att det har tre färre elektroner än antalet protoner), 27 neutroner och massantalet lika med 48.
Av mig Diogo Lopes Dias
Källa: Brazil School - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-atomo.htm

