En isobar transformation sker när gasen har ett konstant tryck. Om det till exempel görs i en öppen miljö kommer transformationen att vara isobar eftersom trycket kommer att vara atmosfärstryck som inte kommer att förändras.
I detta fall varierar temperatur och volym. Två ledande forskare har studerat hur denna variation i isobariska omvandlingar sker. Den första som berättade gasernas volym och temperatur var Jacques Charles (1746-1823) 1787, och sedan kvantifierade Joseph Gay-Lussac (1778-1850) detta förhållande år 1802.
Således uppstod en lag som förklarar de isobara omvandlingarna av gaser, som blev känd som Charles / Gay-Lussac-lagen. Det anges enligt följande:
"I ett system med konstant tryck är volymen av en fast massa av en gas direkt proportionell mot temperaturen."

Det betyder att om vi fördubblar temperaturen kommer den volym som gasen upptar också att fördubblas. Å andra sidan, om vi sänker temperaturen, minskar också gasvolymen i samma proportion.
Detta kan ses i ett mycket enkelt experiment. Om vi placerar en ballong i flaskans hals kommer en fast luftmassa att fångas. Om vi doppar den här flaskan i en skål med isvatten tappar ballongen. Nu, om vi lägger den i en skål med varmt vatten, fylls ballongen.
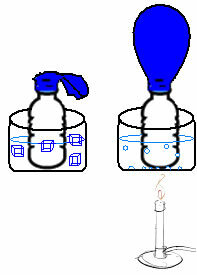
Detta beror på att när temperaturen ökar ökar den kinetiska energin hos gasmolekylerna och hastigheten med vilken de rör sig ökar också. Således expanderar gasen, ökar volymen den upptar och ballongen blåses upp. Motsatsen inträffar när vi sänker temperaturen och lägger den i kallt vatten.
Sluta inte nu... Det finns mer efter reklam;)
Detta förhållande mellan temperatur och volym i isobara transformationer ges av följande förhållande:
V = k
T
"k" är en konstant, vilket kan ses i följande graf:
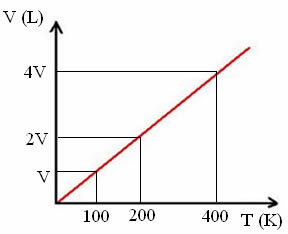
Observera att V / T-förhållandet alltid ger en konstant:
_V_ =_2V_ = _4V_
100 200 400
Således kan vi etablera följande förhållande för isobariska transformationer:
Vförsta = VSlutlig
Tförsta TSlutlig
Det betyder att när det sker någon förändring av gastemperaturen vid konstant tryck kan vi ta reda på dess volym genom detta matematiska uttryck. Motsatsen är också sant, med vetskap om gasens volym får vi reda på vilken temperatur den är vid. Se ett exempel:
"En gasformig massa upptar en volym på 800 cm3 vid -23 ° C, vid ett givet tryck. Vad registreras temperaturen när gasmassan, vid samma tryck, upptar en volym på 1,6 L? ”
Upplösning:
Data:
Vförsta = 800 cm3
Tförsta = -23 ºC, tillägg till 273 har vi 250 K (Kelvin)
VSlutlig = 1,6 L.
TSlutlig = ?
* Först måste vi lämna volymen på samma enhet. Det är känt att 1 dm3 motsvarar 1 liter. som en 1 dm3 är samma som 1000 cm3, verkar det som om 1 liter = 1 000 cm3:
1 L 1000 cm3
x 800 cm3
x = 0,8 L.
* Nu ersätter vi formelvärdena och hittar det slutliga temperaturvärdet:
Vförsta = VSlutlig
Tförsta TSlutlig
0,8_ = 1,6
250 TSlutlig
0,8 TSlutlig = 250. 1,6
TSlutlig = 400
0,8
TSlutlig = 500K
* När vi flyttar till Celsius-skalan har vi:
T (K) = T (° C) + 273
500 = T (° C) + 273
T (° C) = 500 - 273
T (° C) = 227 ° C
Av Jennifer Fogaça
Examen i kemi
Vill du hänvisa till texten i en skola eller ett akademiskt arbete? Se:
FOGAÇA, Jennifer Rocha Vargas. "Isobarisk transformation"; Brasilien skola. Tillgänglig i: https://brasilescola.uol.com.br/quimica/transformacao-isobarica.htm. Åtkomst den 27 juni 2021.
Vad är gaser, vilka egenskaper har gaser, molekylära föreningar, kompressibilitet, fast volym, kinetisk energi medelvärde, absolut temperatur hos en gas, idealgas, Verkliga gaser, perfekt gas, gastillståndsvariabler, gasvolym, årstider
Kemi

Gay-Lussacs lagar, Prousts lag, kemisk reaktion, konstant andel, massor av ämnen, ren substans, analys kvalitativ och kvantitativ, lag om perfekta gaser, lag med konstanta proportioner, lag med bestämda proportioner, lag volymetrisk.