Du metaller de är kemiska grundämnen som presenterar sin huvudsakliga fysiska egenskap förmågan att förlora elektroner och följaktligen bilda metalliska katjoner. Av denna anledning kan de skapa två typer av kemiska bindningar: jonbindningen och metallbindning.
DE jonbindning uppstår när en metall interagerar med ett element av metallisk natur, vilket kan vara en ametal eller väte. I denna typ av bindning har vi förlusten av elektroner av metallerna och vinsten av elektroner av icke-metaller eller väte.
redan den metallbindning är etablerad mellan atomerna i ett enda metalliskt element. Denna typ av bindning förekommer endast mellan atomerna i en enda metall och uteslutande för att en metall inte kan upprätta en kemisk bindning med ett annat annat metallelement.
Allmänna egenskaper hos metaller
Torrsubstanser vid rumstemperatur, med undantag av kvicksilver;
De är lysande;
De har höga smält- och kokpunkter;
De är vanligtvis silverfärgade, med undantag av guld, som är gyllene, och koppar, som är rödaktigt;
Rena metaller bildas av kluster av atomer (av ett enda kemiskt element) som kallas kristallgaller.
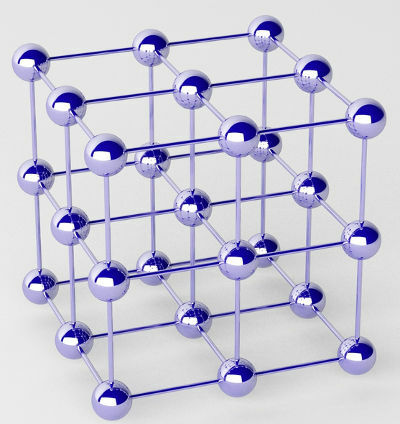
Representation av det kristallina gitteret av en metall
Principer för metallbindning
På metallbindning, de kristallina gitteren som bildar metallerna är faktiskt ett joniskt kluster (endast består av katjoner och elektroner). Elektronerna som finns i metallatomenas valensskikt delokaliseras, det vill säga de lämnar valensskiktet och orsakar att atomen blir en katjon (brist på elektroner).
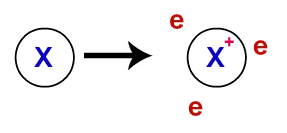
Representation av avlokaliserade elektroner från valensskalet
Efter att ha avlokaliserats börjar elektronerna från metallatomerna omge katjonerna och bildar ett riktigt ”elektronhav”. Var och en av elektronerna som finns i detta hav har förmågan att röra sig fritt genom metallens kristallgitter.

Representation av elektronhavsmodellen
NOTERA: Elektroner "från havet" kan inte lämna kristallgitteret och röra sig genom det.
Egenskaper hos metaller motiverade genom metallbindning
a) smidbarhet
Genom en metall är det möjligt att producera ark med olika tjocklekar och ark. Det är tack vare den här egenskapen hos metaller att vi kan bygga olika föremål, såsom knivar, svärd etc.

Ett svärdsblad är tillverkat av metall
b) Konduktivitet
Metaller är i allmänhet bra ledare för elektrisk ström och värme. När någon metall är i kontakt med en värmekälla eller en elektrisk strömkälla kan den leda dem.

En aluminiumpanna i kaminen blir helt het på grund av konduktivitet.
c) Duktibilitet
Genom en metall kan vi producera ledningar. Användningen av en metall i form av ledningar underlättar dess användning, särskilt i förhållande till elektrisk ledningsförmåga.

En metall, såsom koppar, kan användas för att tillverka ledningar.
Av mig Diogo Lopes Dias
Källa: Brazil School - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-ligacao-metalica.htm

