Sulfoneringsreaktioner i alkaner dom är organiska substitutionsreaktioner, utförd i syfte att producera sulfonsyror (organiska föreningar som har SO-gruppen3H fäst vid en kolatom eller till en kolkedja) och vatten (H2O).
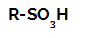
Strukturformel för en sulfonsyra
För att genomföra en sulfoneringsreaktion på alkanermåste vi blanda en alkan (förening bildad av en kolkedja mättad med endast kol- och väteatomer) och svavelsyra (H2ENDAST4koncentrerades, utsattes för upphettning (∆).
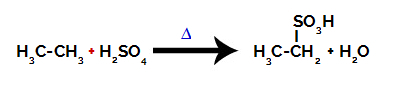
Kemisk ekvation som representerar sulfoneringen av en tvåkolalkan
Principer för sulfoneringsreaktionen i alkaner
Till exempel alkansulfoneringsreaktion det är en substitutionsreaktion, vi har ett utbyte mellan mindre komponenter elektronnegativitet av reaktanterna, det vill säga mellan alkan och svavelsyra. Alkan har väte och svavelsyra, sulfongruppen.
Nedan har vi steg för steg mekanismen för a sulfoneringsreaktion i alkaner. Som ett exempel kommer vi att använda den enklaste alkanen, metan (CH4):
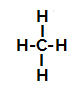
Strukturformel för metan
Första steget: Störning av bindningen mellan hydroxyl (OH) och svavel (S) i svavelsyra.
Varje hydroxylgrupp som finns i svavelsyra kännetecknas av att vara mer elektronegativ. Vid upphettning under reaktionen är tendensen att bindningen mellan hydroxylgruppen och svavlet bryts:
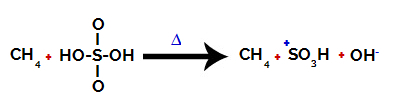
Störning av bindningen mellan svavel och hydroxyl
Brytningen av bindningen för alla hydroxyler sker dock inte på grund av den elektroniska omläggningen i strukturen. En hydroxidanjon (OH) erhålls sedan.-) och en sulfonisk katjon.
Andra steget: Hydroxylgruppangrepp på alkanmolekylen.
Sedan hydroxigruppen (OH-) utför ett angrepp på alkanen och orsakar att bindningen mellan kol och väte (som är mer ömtålig på grund av skillnaden i elektronegativitet mellan dem) bryts.
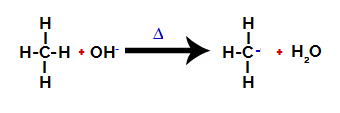
Bryta bindningen mellan kol och väte i alkan
Notera: Störning av bindningen mellan kol och väte kommer alltid att förekomma oftast vid kol med lägre elektronisk densitet eller laddning. Ju färre väten kol har, eller ju fler grupper som är fästa vid det, desto lägre är dess elektrontäthet. Så vi har:
Tertiärt kol
Efter att bindningen har brutits blir alkanen ett elektronbristkol (karbokation). Hydroxidgruppen (OH)-) interagerar med det frisatta väte och bildar en vattenmolekyl.
3: e steget: Attack av den bildade radikalen på sulfongruppen.
Slutligen attackeras sulfongruppen av resten av alkanen och bildar en sulfonsyra.
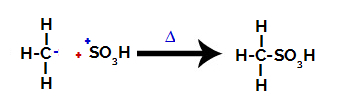
Strukturer som interagerar och bildar sulfonsyra
Exempel på ekvationer som representerar sulfoneringsreaktioner i alkaner
1: a exemplet: Sulfonering av propan.
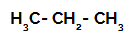
Strukturformel av propan
Propan har två primära kol och ett sekundärt kol, som har olika laddningar eftersom de är bundna till olika mängder väte. Eftersom kol är mer elektronegativt än väte har dessa kol olika elektrondensiteter.
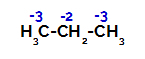
Fördelning av laddningar på varje kolatom i propan
På primära kol är laddningen -3 (eftersom den är bunden till tre väten), och på det sekundära kolet är laddningen -2 (eftersom den är bunden till två väten). Således kommer det att brytas i bindningen mellan kol och väte, ibland vid kol 1 (av en molekyl), ibland vid kol 2 (för en annan molekyl).
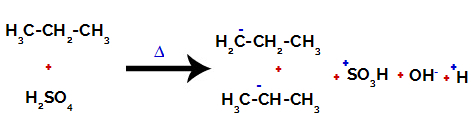
Bryta bindningen mellan kol och väte på olika kol
Efter brytningarna mellan bindningarna, både i svavelsyra och i alkan, bildas produkter med utbyte av väte på kol 1 med en sulfongrupp, och detsamma sker på kol 2.
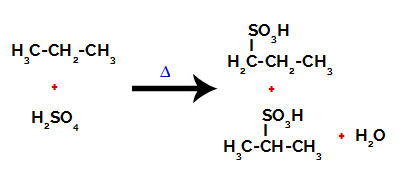
Produkter som bildas genom sulfonering av propan
2: a exempel: Sulfonering av 2-metyl-butan.

Strukturformel för 2-metyl-butan
2-metylbutan har tre primära kol, ett sekundärt kol och ett tertiärt kol, som har olika laddningar och följaktligen olika elektroniska densiteter, vilket framgår av följande struktur:
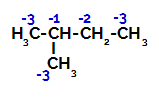
Fördelning av elektroniska laddningar i 2-metyl-butan
Därför finns det i 2-metyl-butan flera möjligheter att bryta bindningen mellan kol och väte, som kan förekomma på kol 1 (av en molekyl), kol 2 (av en annan molekyl), kol 3 eller kol 4. Det är dock anmärkningsvärt att störningen vid kol nummer 2 är vanligare.
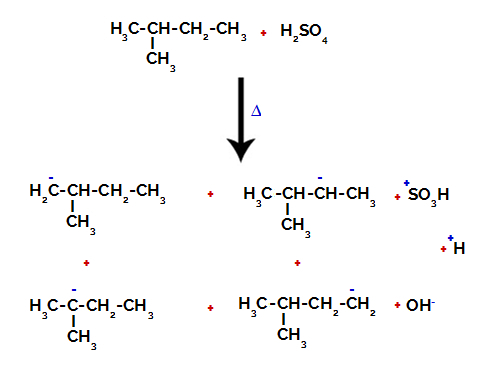
Bryta bindningen mellan kol och väte på olika kol
Efter brottet mellan bindningarna, både i svavelsyra och i alkan, bildas produkter med utbyte av väte på kol 1 med en sulfongrupp, och detsamma händer på kol 2.

Produkter bildade genom sulfonering av 2-metylbutan
Av mig Diogo Lopes Dias
Källa: Brazil School - https://brasilescola.uol.com.br/quimica/reacoes-sulfonacao-alcanos.htm
