hydratiserat salt det är en salt- i vilka jonerna av föreningen inkorporerar vattenmolekyler i sina kristallina gitter, vilket gör att dessa molekyler blir en del av saltkristallen.
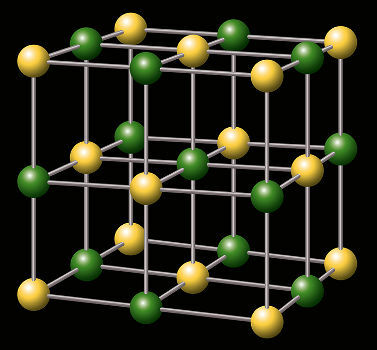
Representation av det kristallina gitteret av ett salt
Den kemiska formeln för a hydratiserat salt följer ett mönster, där vi har närvaron av vilken katjon som helst (X+), vilken anjon som helst (Y-) och en viss mängd (n) i mol vatten, vilket kan ses i följande modell:
XY.nH2O
Att bilda nomenklatur för a hydratiserat saltmåste vi utföra följande regler:
Anjonnamn + de + katjonnamn + prefix + hydratiserad
Anmärkning: Prefixet som anges i nomenklaturregeln avser mängden i mol vatten närvarande i saltformeln, sålunda för 1 mol (mono), 2 mol (d), 3 mol (tri), etc.
1: a exemplet: FeCl2.2.H2O
Detta hydratiserade salt har följande komponenter:
Järnkatjon II (Fe+2);
Kloridanjon (Cl-);
2 mol H2O (prefix di).
Så dess namn kommer att vara järn II-kloriddihydrat.
2: a exemplet: MgSO44.7.H2O
Detta hydratiserade salt har följande komponenter:
Magnesiumkatjon (Mg+2);
Sulfatanjon (SO4-2);
7 mol H2O (prefix hepta).
Så dess namn kommer att vara magnesiumsulfatheptahydrat.
3: e exemplet: ZnBr2.8.H2O
Detta hydratiserade salt har följande komponenter:
Zink katjon (Zn+2);
Bromidanjon (Br-1);
8 mol H2O (prefix okta).
Så dess namn kommer att vara zinkbromidoktahydrat.
kemisk modifiering
När ett hydratiserat salt genomgår en uppvärmningsprocess, släpps de vattenmolekyler som införlivas i den kristallina strukturen i form av ånga och lämnar bara ett enkelt salt.
Av mig, Diogo Lopes
Källa: Brazil School - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-sal-hidratado.htm