vi har en blandning av lösningar med olika lösta ämnen utan kemisk reaktion när två eller flera blandningar som har ämnen med samma jon gemensamt (antingen samma katjon eller samma anjon). Som i exemplet nedan:
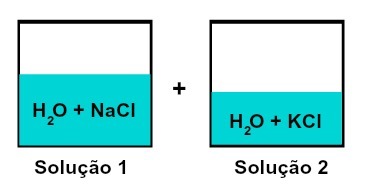
Blandning av lösningar som har olika lösta ämnen
Lösning 1 är vatten och natriumklorid (NaCl), medan lösning 2 har vatten och kaliumklorid (KCl). När vi blandar ihop har vi en blandning av olika lösta lösningar utan kemisk reaktion, eftersom båda salterna som används har kloridanjonen (Cl-).
1- Egenskaper för blandningar av olika lösningsmedelslösningar utan kemisk reaktion
När en blandning av lösningar som har olika lösta ämnen utan kemisk reaktion utförs kontrolleras alltid egenskaperna nedan:
Massan av var och en av de lösta ämnena förändras inte (om vi i lösning 1 har 10 g löst ämne och i 2, 30 g, till exempel, efter blandning har vi samma massa av varje löst ämne),
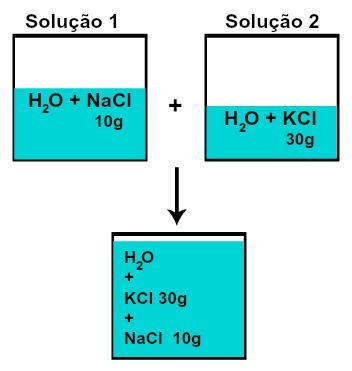
Massa av var och en av de lösta ämnena efter blandningslösningar utan kemisk reaktion
DE mängd materia (n) av vart och ett av de lösta ämnena förändras inte (om vi i lösning 1 har 5 mol löst ämne och i 2, 4 mol, till exempel, efter blandning har vi samma mängd materia av varje),
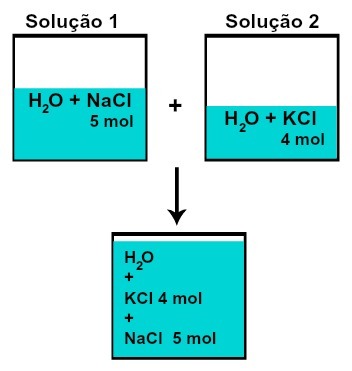
Antal mol av varje löst ämne efter blandningslösningar utan kemisk reaktion
Volymen på den slutliga lösningen, VF, är resultatet av summan av volymerna för var och en av de blandade lösningarna (om vi i lösning 1 har 200 ml och i lösning 2, 300 ml, till exempel, efter blandning har vi 500 ml volym),
VF = V1 + V2
2- Formler som används vid beräkningar av blandningslösningar av olika lösta ämnen utan kemisk reaktion.
Som i denna typ av blandning har vi bara en ökning av mängden lösningsmedel i förhållande till var och en av lösta ämnen, måste vi beräkna den slutliga koncentrationen av var och en av de lösta ämnena med hjälp av följande uttryck:
a) Till gemensam koncentration (Ç)
För lösning 1: multipliceringen av koncentrationen av lösning 1 med dess volym är lika med den slutliga koncentrationen multiplicerad med dess volym
Ç1.V1 = CF.VF
För lösning 2: multipliceringen av koncentrationen av lösning 2 med dess volym är lika med den slutliga koncentrationen multiplicerad med dess volym
Ç2.V2 = CF.VF
b) Till koncentration i kvantitet av materia eller molaritet (M)
För lösning 1:
M1.V1 = MF.VF
För lösning 2:
M2.V2 = MF.VF
c) Koncentration i kvantitet av materia av varje jon som finns i lösningen
Om vi måste bestämma koncentrationen av en eller alla joner som finns i den slutliga lösningen måste vi:
1º: Kom ihåg att jonkoncentrationen ges genom multiplicering av koncentrationen (M), av det lösta ämnet som den kommer från, genom dess index i ämnesformeln. Så för jonen Y, i substans 1, XY3kommer koncentrationen att vara:
[Y]1 = 3. M
När det gäller solute2, ZY, skulle koncentrationen av Y ges av:
[Y]2 = 1. M
2º: Om vi har mer än en löst substans som frigör samma jon, till exempel, löses XY3 och ZY, som har samma jon Y, koncentrationen av denna jon i den slutliga lösningen ges av summan av dess koncentrationer för varje löst ämne:
[Y]F = [Y]1 + [Y]2
3- Exempel på beräkningar med blandningslösningar av olika lösta ämnen utan kemisk reaktion
Exempel 1: (PUC SP) I en bägare blandades 200 ml av en vattenlösning av kalciumklorid (CaCl)20,5 mol koncentration. L–1 och 300 ml av en 0,8 mol lösning. L–1 natriumklorid (NaCl). Den erhållna lösningen har en kloridanjonkoncentration av ungefär:
a) 0,34 mol. L–1
b) 0,65 mol. L–1
c) 0,68 mol. L–1
d) 0,88 mol. L–1
e) 1,3 mol. L–1
Uppgifterna från övningen var:
Lösning 1:
Volym (V1200 ml
Molekoncentration (M10,5 mol. L–1
Lösning 2:
Volym (V2300 ml
Molekoncentration (M2): 0,8 mol. L–1
För att bestämma koncentrationen av kloridanjoner (Cl-) måste vi följa dessa steg:
Steg 1: beräkna volymen på den slutliga lösningen
VF = V1 + V2
VF = 200 + 300
VF = 500 ml
Steg 2: Beräkna molkoncentrationen av den slutliga lösningen med avseende på CaCl-lösningen2, med hjälp av uttrycket nedan:
M1.V1 = MF.VF
0,5,200 = MF.500
100 = MF.500
100 = MF
500
MF = 0,2 mol. L–1
Steg 3: Beräkna molkoncentrationen av klorid [Cl-]1, i den slutliga lösningen, från CaCl-lösningen2, med hjälp av uttrycket nedan:
NOTERA: I formeln har vi multiplicerat molariteten med 2 eftersom vi har index 2 i Cl, i den lösta formeln CaCl2.
[Cl-]1 = 2.MF
[Cl-]1 = 2. 0,2
[Cl-]1 = 0,4 mol. L–1
Steg 4: Beräkna den molära koncentrationen av den slutliga lösningen med avseende på NaCl-lösningen, med hjälp av uttrycket nedan:
M2.V2 = MF.VF
0,8,300 = MF.500
240 = MF.500
240 = MF
500
MF = 0,48 mol. L–1
Steg 5: Beräkna molkoncentrationen av klorid, [Cl-]2, i den slutliga lösningen, från NaCl-lösningen, med användning av uttrycket nedan:
NOTERA: I formeln har vi multiplicerat molariteten med 1 eftersom vi har index 1 i Cl, i formeln för den lösta NaCl.
[Cl-]2 = 1.MF
[Cl-]2 = 1. 0,48
[Cl-]2 = 0,48 mol. L–1
Steg 6: Beräkna den totala mängden kloridjoner i den slutliga lösningen
För att göra detta, lägg bara till molkoncentrationerna av klorider för var och en av de lösta ämnena i steg 3 och 5:
[Cl-]F = [Cl-]1+ [Cl-]2
[Cl-]F = 0,4 + 0,48
[Cl-]F = 0,88 mol. L–1
Exempel 2: Till en lösning av 500 ml 6 mol / L KOH sattes 300 ml K-lösning.2ENDAST3 3 mol / L. Vad är koncentrationen av var och en av de lösta ämnena i den resulterande blandningen
a) 3,75 och 3,0 mol / l
b) 3,75 och 1,215 mol / l
c) 4,5 och 1,125 mol / l
d) 3,75 och 1,125 mol / 1
e) 4,5 och 1,215 mol / l
Uppgifterna från övningen var:
Lösning 1:
Volym (V1500 ml
Molekoncentration (M1): 6 mol. L–1
Lösning 2:
Volym (V2300 ml
Molekoncentration (M23 mol. L–1
För att bestämma koncentrationen av kloridanjoner (Cl-) måste vi följa dessa steg:
Steg 1: beräkna volymen på den slutliga lösningen
VF = V1 + V2
VF = 500 + 300
VF = 800 ml
Steg 2: Beräkna molkoncentrationen av den slutliga lösningen med avseende på KOH-lösningen med hjälp av uttrycket nedan:
M1.V1 = MF.VF
6500 = MF.800
3000 = MF.800
3000 = MF
800
MF = 3,75 mol. L–1
Steg 3: Beräkna molkoncentrationen av den slutliga lösningen i förhållande till löst K2ENDAST3, med hjälp av uttrycket nedan:
M2.V2 = MF.VF
3,300 = MF.800
900 = MF.800
900 = MF
800
MF = 1,125 mol. L–1
Av mig Diogo Lopes Dias
Källa: Brazil School - https://brasilescola.uol.com.br/quimica/mistura-solucoes-com-solutos-diferentes-sem-reacao-quimica.htm

