Dissociation av baser det är en fysisk process som uppstår med denna viktiga grupp av oorganiska ämnen när de löses i vatten, eller när de går igenom fusionsprocessen (passage från fast tillstånd till flytande tillstånd genom uppvärmning).
I allmänhet är fenomenet basdissociation det är frisättningen av katjoner och anjoner som bildar Jonisk förening, som i detta fall är basen. Så, under basdissociation, frisläppandet av joner som redan finns i föreningen, det vill säga inga nya joner bildas.
Basen bildas av vilken metall som helst (X), som är katjon av föreningen, eller av ammoniumkatjonen (NH-gruppen4+), bunden till hydroxidanjonen (representerad av OH-gruppen), såsom i representationerna nedan:
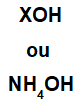
Allmänna representationer av en basformel
formen av representerar basdissociation det görs genom en ekvation där vi i reaktanten har basen och i produkterna har vi jonerna (katjoner och anjoner). Vad som gör skillnaden är hur dissociationen sker:
Upplösning av basen i vatten:
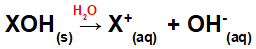
Ekvation som representerar dissociationen av en bas i ett vattenhaltigt medium
Dissociation genom basfusion:
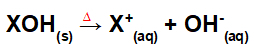
Ekvation som representerar dissociationen av en bas genom fusionsprocessen
När vi analyserar de allmänna ekvationerna ovan verifierar vi att vi i alla av dem alltid kommer att ha basen, katjonen (som är metallen eller NH-gruppen4+) och anjonen (OH-). Men är de alla så? Är det ingen skillnad mellan dem? För den första frågan är svaret nej och för den andra frågan är svaret ja.
När vi utför dissociation från en bas, är det grundläggande först att analysera basformeln, för från den kan vi bestämma belastningen på katjon och molmängden hydroxidanjoner, eftersom molmängden katjon är standard (alltid 1 mol).
Det är värt att komma ihåg att mängden OH-grupper som finns i basformeln bestämmer laddningen av katjonen och mängden i mol av hydroxidanjonen i dissociationen av basen.
Låt oss titta på exemplen på aluminiumhydroxid [Al (OH)3] och guldhydroxid (AuOH). I aluminiumbasformeln finns tre OH-grupper och i guldbasformeln endast en OH-grupp. Således har vi i dissociationen av dessa baser:
Al (OH) dissociation3:
Eftersom denna bas har tre OH-grupper i formeln kommer laddningen på katjonen att vara +3 och mängden i mol av anjoner är lika med 3 mol, vilket vi kan se i följande ekvation:
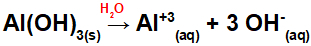
Aluminiumbasdissociationsekvation i vattenhaltigt medium
Dissociation från AuOH:
Eftersom denna bas har en OH-grupp i formeln kommer laddningen på katjonen att vara +1 och mängden i mol av anjoner är lika med 1 mol, vilket vi kan se i följande ekvation:
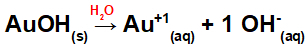
Ekvation av basdissociation med guld i vattenhaltigt medium
Av mig Diogo Lopes Dias
Källa: Brazil School - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-dissociacao-das-bases.htm
