diffusion och effusion är två lagar som föreslagits av den skotska kemisten Thomas Graham, på 1800-talet, baserat på hans studier om gasblandningar och beteendet hos gaser när du går igenom väggarna i en container.
Bland de iakttagelser som görs av Thomas Graham om gasernas beteende i förhållande till diffusion och effusion kan vi lyfta fram följande:
En gas har alltid en tendens att passera genom små hål i fasta ämnen;
Ju större molekylmassa desto större är dess svårighet att passera genom hålen i fast material;
Ju lägre gasens densitet, desto större är dess rörelsehastighet.
Ju högre temperatur en gas utsätts för, desto högre hastighet med vilken den sprider sig i omgivningen eller passerar genom en öppning;
- En gas förblir aldrig statisk på en viss plats.
Diffusion
Diffusion det är ett fysiskt fenomen som består i förmågan hos en gas att diffundera (det vill säga sprida sig) genom hela rymden i ett område eller inuti en behållare. Av den anledningen kan vi säga att en gas aldrig inom ett utrymme är begränsad till en enda plats.

Representation av förekomsten av en sändning
Dessutom kan vi definiera diffusion fortfarande som kapaciteten som en gas har att blanda med en annan, när den placeras i samma behållare och bildar en homogen gasblandning.
Ett exempel är när gaser kommer ut från fordonets avgaser. Så giftiga som de är, orsakar de inte kortsiktiga skador på människor, eftersom de sprider sig i atmosfären och minskar följaktligen deras koncentration.
Utgjutning
Utgjutning det är ett fysiskt fenomen som består i att en gas passerar genom hål som existerar i en viss behållares väggar, det vill säga den består i utloppet av en gas från en miljö till en annan.

Representation av förekomsten av en utgjutning
Ett exempel är när ballongerna blåses upp för en fest och nästa dag tappas de alla, allt på grund av luften som flyr genom hålen i ballongerna.
Beräkningar relaterade till diffusion och effusion
Vi kan beräkna, enligt ekvationer föreslagna av Graham, den hastighet med vilken en gas presterar diffusion eller effusion. Enligt Graham är diffusions- och effusionshastigheterna för två gaser blandade i en behållare alltid omvänt proportionell mot kvadraten av deras relativa densiteter eller deras molära massor.
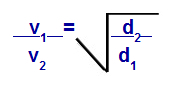
Grahams lag med avseende på densitet
v1 = hastighet (effusion eller diffusion) av gas 1 i blandningen;
v2 = hastighet (effusion eller diffusion) av gasen 2 i blandningen;
d1 = densitet av gas 1 i blandningen;
d2 = densitet av gas 2 i blandningen;
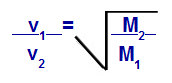
Grahams lag om molarmässa
v1 = hastighet (effusion eller diffusion) av gas 1 i blandningen;
v2 = hastighet (effusion eller diffusion) av gasen 2 i blandningen;
M1 = molmassa av gas 1 av blandningen;
M2 = molmassa av gas 2 i blandningen.
Av mig Diogo Lopes Dias
Källa: Brazil School - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-difusao-efusao.htm