I en isotermisk transformation förvandlas volym och tryckvariation av en viss gas, men konstant temperatur; därav ursprunget till det isotermiska namnet (grekiska: iso = lika; termo = värme).
Forskarna Boyle och Mariotte genomförde isolerat liknande experiment och resultatet erhölls: när trycket ökar minskar gasens volym.
Tänk bara till exempel på sprutans kolv. Om vi applicerar externt tryck på den här kolven, det vill säga om vi ökar trycket, minskar luftvolymen inuti sprutan och vice versa.
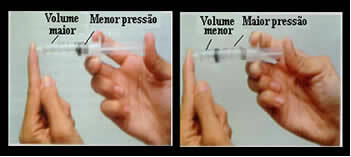
Volym och tryck är omvänt proportionella: i den vänstra panelen är trycket litet och volymen upptagen av luft är stor. Till höger, när mer tryck appliceras på sprutkolven, minskar volymen.
Detta är inte ett isolerat fall, det är något som upprepas med vanlig regelbundenhet för gaser. Därför angavs detta faktum i form av en lag, som kan beskrivas på följande sätt:
| Boyles lag eller Boyle-Mariottes lag: Under konstant temperatur är volymen som upptas av en fast massa av en gas omvänt proportionell mot dess tryck. |
Det betyder att om vi fördubblar gasens tryck halveras dess volym och så vidare. När två sådana mängder är omvänt proportionella är deras produkt konstant; sålunda matematiskt kan detta förhållande representeras enligt följande:
| P.V = k |
Där k = konstant.
Således, om vi i en första situation har tryckvärdet för en viss gas som P1 och dess respektive volym som V1, så måste vi:
| P1. V1 = k |
Om vi ökar detta tryck till P2 ändras dess volym också till V2 och igen måste vi:
| P2 . V2 = k |
Således når vi slutsatsen:
| P1. V1 = P2. V2 |
Denna beständighet kan ses av exemplet i tabellen nedan, av tryck och volymer av en gas med en fast massa:
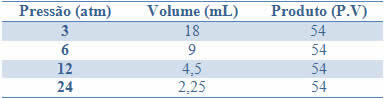
Genom att grafera dessa värden ser vi bildandet av en kurva.
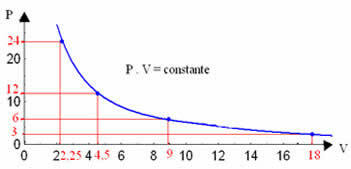
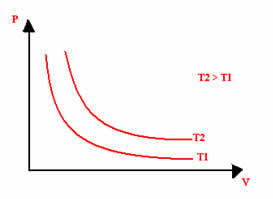
Den grafiska representationen av en isotermisk transformation kommer alltid att vara en hyperbol, oavsett värdena på tryck och volym och temperatur vid vilken experimentet utfördes. Denna hyperbol kallas isoterm; Så som framgår av diagrammet nedan ger olika temperaturer upphov till olika isotermer.
Källa: Brazil School - https://brasilescola.uol.com.br/quimica/transformacao-isotermica-ou-lei-boyle.htm
