Hybridisering är namnet på fusionen eller sammanslutningen av ofullständiga atomorbitaler, ett fenomen som ökar antalet kovalenta bindningar som en atom kan göra. Att komma ihåg att orbital är den del av atomen där det finns större sannolikhet för att hitta en elektron.
Att veta antalet bindningar som en atom skapar och förstår fenomenet hybridisering, är det nödvändigt att känna till några grundläggande punkter om atomen:
1O punkt: energinivån
Energiundernivåerna som en atom kan ha är s, p, d, f.
2O punkt: antal orbitaler per delnivå
Varje energidelnivå har olika mängd orbitaler, som vi kan se nedan:
Undernivå s: 1 orbital;
p undernivå: 3 orbitaler;
Undernivå d: 5 orbitaler.
Den generiska representationen av dessa orbitaler görs enligt följande:
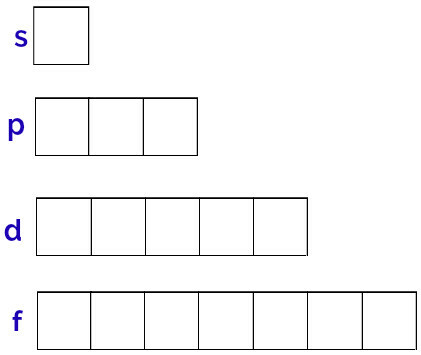
Representation av orbitalerna för varje delnivå
Enligt Pauli kan ett orbital ha högst 2 elektroner, med snurrar (roterande rörelser) mittemot.
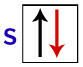
Representation av s orbital med dess elektroner
Enligt Hund får ett omlopp i ett undernivå endast sin andra elektron när alla andra orbitaler i det undernivån redan har fått den första elektronen.
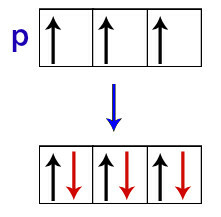
Fördelning av elektroner i p undernivå orbitaler
3O punkt: elektronisk distribution
För att förstå hybridisering och antalet bindningar som en atom skapar är det viktigt att utföra elektronisk distribution på Linus Pauling-diagrammet.

Linus Pauling-diagram
Kom ihåg att det maximala antalet elektroner i varje delnivå är:
s = 2 elektroner;
p = 6 elektroner;
d = 10 elektroner;
f = 14 elektroner.
Efter denna korta granskning kan vi definiera nu vad är hybridisering. För detta kommer vi att använda det kemiska grundämnet bor (atomnummer = 5) som ett exempel.
När vi utför elektronisk bordistribution har vi:
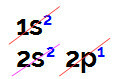
Elektronisk borfördelning i Linus Pauling-diagrammet
Det är möjligt att observera i denna fördelning att bor har 2 elektroner i s undernivå och 1 elektron i p undernivå av valenslager.
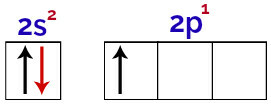
Elektroner i borvalensskiktets orbitaler
Eftersom bor har 1 ofullständig omlopp, bör det därför bara göra en kovalent bindning, eftersom antalet bindningar alltid är direkt relaterat till antalet ofullständiga orbitaler.
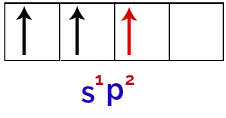
Således, när boratomen tar emot energi från den yttre miljön, blir dess elektroner, särskilt de i valensskalet, upphetsade. Detta gör att en av elektronerna från s orbital lämnar och upptar en av de tomma p-orbitalerna, vilket resulterar i 3 ofullständiga atomorbitaler, som du kan se i följande bild:

Representation av boratomens upphetsade tillstånd
Slutligen finns det föreningen av den ofullständiga orbitalen med de ofullständiga p-orbitalerna. Denna union heter hybridisering. Eftersom vi har en fusion av en s orbital med två p kallas den hybridisering sp2.
Representation av hybridiserade orbitaler i boratomen
Förutom bor genomgår flera andra kemiska element fenomenet hybridisering, såsom svavel (S), Xenon (Xe), fosfor (P), kol (Ç), beryllium (Vara).
Av mig Diogo Lopes Dias
Källa: Brazil School - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-hibridizacao.htm
