Vi kan notera det när vi ökar koncentrationen av en eller alla reaktanter som deltar i en kemisk reaktion, ökar dess utvecklingshastighet, det vill säga reaktionens hastighet.
Motsatsen är också sant. Till exempel rekommenderas det för närvarande att vi använder alkoholgel istället för vanlig alkohol, eftersom det finns mindre risk för att det förbränns och därmed undviker olyckor. Vanlig flytande alkohol är faktiskt en blandning av alkohol och vatten, med gelalkohol som innehåller en mindre mängd alkohol. Därför, när koncentrationen av en av förbränningsreaktanterna reduceras, i fallet med alkohol, fortskrider reaktionen långsammare. Å andra sidan, ju renare alkohol desto snabbare förbränningsreaktionen.

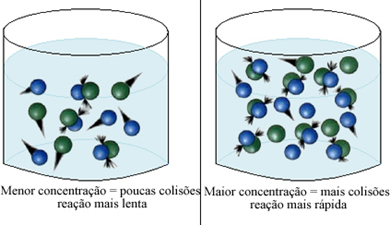
Som anges i texten Villkor för förekomst av kemiska reaktioner, är ett av villkoren för att en reaktion ska kunna ske effektiv kollision mellan partiklarna. Således, ökningen av koncentrationen av reagens gör det möjligt att ha en större mängd partiklar eller molekyler begränsade i samma utrymme. Detta ökar mängden kollisioner mellan dem och ökar också sannolikheten för att effektiva kollisioner kommer att resultera i att reaktionen inträffar. Resultatet är att reaktionen sker snabbare.
För att se detta, tänk på följande exempel: när vi har en brinnande glöd och vi vill att denna förbränning ska bearbetas snabbare, blåser eller fläktar vi glöd? Varför fungerar det här?
En av reaktanterna i denna förbränningsreaktion är syre i luften. När vi skakar av tar luftströmmen bort askan som bildas under förbränningen och detta underlättar kontakt med syre med glödet. På detta sätt ökar vi kontakten mellan reaktanterna och påskyndar förbränningsreaktionen.
I korthet har vi:

När man arbetar med gaser är ett sätt att öka koncentrationen av reaktanter sänk trycket. När vi gör detta minskar vi volymen och följaktligen ökar reagenskoncentrationerna.

Av Jennifer Fogaça
Examen i kemi
Källa: Brazil School - https://brasilescola.uol.com.br/quimica/concentracao-dos-reagentes-velocidade-das-reacoes.htm
