DE löslighet eller löslighetskoefficient, det är en fysisk egenskap hos materia som alltid praktiskt bestäms i laboratoriet. Det är relaterat till kapaciteten som ett material kallas löst, presenter som ska lösas upp av en annan, den lösningsmedel.
När det gäller löslighet kan lösta ämnen klassificeras enligt följande:
Lösliga ämnen: de som löser sig i lösningsmedlet. Natriumklorid (löst) är till exempel lösligt i vatten (lösningsmedel);
Lätt löslig: de som har svårt att lösa sig i lösningsmedlet. Detta är fallet med kalciumhydroxid [Ca (OH)2] (löst) i vatten;
Olösliga: de löser sig inte i lösningsmedlet. Sand (löst) är till exempel olösligt i vatten.
DE löslighet är mycket förknippat med beredningen av lösningar (homogena blandningarFör att erhålla en lösning är det väsentligt att det använda lösningsmedlet är lösligt i lösningsmedlet.
Faktorer som påverkar lösligheten
Även när lösningsmedlet är lösligt i lösningsmedlet finns det några faktorer som kan påverka lösningsmedlets förmåga att lösa sig. Är de:
a) Förhållandet mellan mängden löst ämne och lösningsmedel
Lösningsmedlet har alltid en gräns för löst ämne, det kan lösas upp. Om vi ökar mängden lösningsmedel samtidigt som mängden lösningsmedel bibehålls tenderar lösningsmedlet att lösa upp allt använt lösningsmedel.
B) Temperatur
Temperatur är den enda fysiska faktorn som kan modifiera lösningsmedlets löslighet i förhållande till en given lösning. Denna modifiering beror på lösningsmedlets natur, vilket vi kommer att se nedan:
endoterm löst ämne: är den som vi lyckas lösa upp en större massa så länge lösningsmedlet har en temperatur högre än rumstemperatur. Ju varmare lösningsmedlet desto mer löst löses det upp.
Exempel: Det är möjligt att lösa upp en större mängd malet kaffe när vattnet är varmt.
Exoterm lösning: är den som vi lyckas lösa upp en större massa så länge lösningsmedlet har en temperatur som är lägre än rumstemperatur. Ju kallare lösningsmedlet desto mer löst löses upp.
Exempel: Det är möjligt att lösa upp en större mängd koldioxid när läsket är kallt.
Sätt att bestämma lösligheten
Eftersom lösligheten är en egenskap som bestäms på ett experimentellt sätt har materialen i allmänhet redan fått sina lösligheter utvärderade i de mest olika lösningsmedlen. Således kan vi få tillgång till lösligheten för en löst substans i ett visst lösningsmedel enligt följande:
a) Analys av en tabell
Ofta kan eleven stöta på löslighet från tolkningen av ett bord. Se följande exempel:
Exempel: (UEPG - anpassad) Tabellen nedan visar lösligheten av Li-salt2CO3 i 100 gram vatten.

Tabellen visar massvärdena i gram Li2CO3 som kan lösas i 100 gram vatten, från 0 OC till 50 OÇ. Vi kan se att ju varmare vattnet är, desto mindre Li2CO3 upplöses. Därför Li2CO3 det är en exoterm lösning (den kommer att lösas mer om vattnet är kallt).
b) Analys av ett diagram
Lösligheten kan bedömas genom att tolka en graf. För att göra detta, bestäm bara temperaturen, vrid den till kurvan och vrid sedan kurvan till y-axeln, vilket är massan i gram löst ämne som kommer att lösas upp.
Exempel: (UFTM - anpassad) Grafen visar löslighetskurvan för ett AX-salt2.
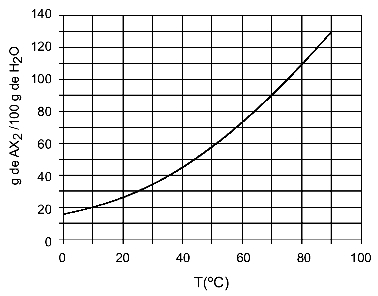
Grafen säger att mängden vatten (lösningsmedel) på y-axeln är 100 gram. För löst AX2bestämmer vi mängden vatten vid följande temperaturer:
30OÇ: När vi slår på temperaturen 30OC till kurvan och sedan kurvan till y-axeln, vi har att vid denna temperatur kan 100 gram vatten lösa upp cirka 35 gram löst AX2.
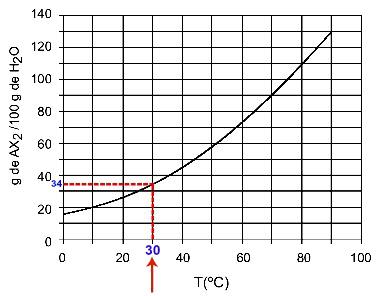
Bestämning av AX-löslighet2 vid 30OÇ
40OÇ: När vi slår på temperaturen 40OC till kurvan och sedan kurvan till y-axeln, vi har att vid denna temperatur kan 100 gram vatten lösa upp cirka 45 gram löst AX2.
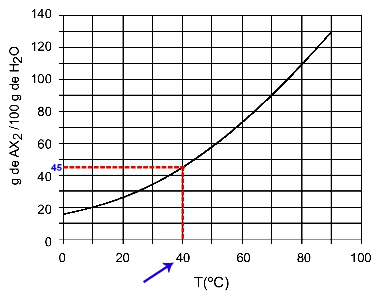
Bestämning av AX-löslighet2 vid 40OÇ
Eftersom den lösta mängden löst ämne är större för varje temperaturökning, har vi AX2 det är en endotermisk lösning.
c) texttolkning
Se följande exempel:
Exempel: (PUC-MG) Vissa ämnen kan bilda homogena blandningar med andra ämnen. Ämnet som är i den största mängden kallas ett lösningsmedel och det som är i den minsta mängden kallas ett lösningsmedel. Natriumklorid (NaCl) bildar en homogen lösning med vatten, i vilken det är möjligt att solubilisera, vid 20 ° C, 36 g NaCl i 100 g vatten.
Texten säger att om vi har 100 gram vatten (lösningsmedel), vid en temperatur på 20 OC, är det möjligt att lösa upp till 36 gram NaCl.
Av mig Diogo Lopes Dias
Källa: Brazil School - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-solubilidade.htm

