Vanligtvis är reaktionerna från vattenhaltig elektrolys och magtrost elektrolys de utförs med grafit- och platinaelektroder, som inte deltar i reaktionen; de leder bara elektrisk ström. Det finns dock några specifika fall där det är nödvändigt att använda aktiva elektroder, det vill säga, som genomgår reduktion och oxidation.
De viktigaste användningsfallet för dessa elektroder som deltar i redoxprocessen är: a elektrolytisk metallrening, såsom zink, kobolt, nickel och särskilt koppar; och även galvanisering. Låt oss se hur varje fall uppstår:
• Elektrolytisk rening av koppar: denna elektrolytiska kopparraffinering kan ge en renhet på cirka 99,9% och används huvudsakligen för att tillverka koppartrådar som, om de har minsta möjliga orenhet, kan ha sin förmåga att leda mycket elektrisk ström minskat.
Observera hur denna process sker, se schematisk bild av ett elektrolytiskt kärl monterat nedan:

En potentiell skillnad appliceras på den vattenhaltiga kopparsulfatlösningen (CuSo4 (aq)) - som leder elektricitet - så att anoden, som är en oren metallisk koppar, tappar elektroner, det vill säga den genomgår oxidation och frigör dess katjoner (Cu
2+), som deponeras på den negativa plattan. Detta kan vara en inert platina platta, eller, bättre, en ren kopparplatta. Det utgör katoden, som reduceras när koppar deponeras i den. Således är halvreaktionerna som uppstår i elektroderna: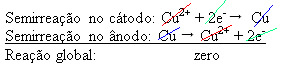
Det faktum att det gav ett nollresultat tyder på att det inte fanns någon kemisk reaktion utan bara transport av koppar. Längst ner i behållaren finns andra orena ämnen som fanns i koppar som guld, silver, kiseldioxid (sand) och andra mineraler, som till och med kan säljas.
• Galvanisering: en metallbeläggning appliceras på ett material som ska skyddas mot korrosion.
Metallen som valts för beläggningen - som kan vara krom (förkromning), nickel (nickelplätering), silver (silverplätering), guld (förgyllning) eller zink (galvanisering) - kommer att vara den anod, positiva elektroden, som genomgår oxidation och förlorar elektroner. Det genomgår oxidering istället för det material som har skyddats, eftersom dess minskningspotential är större.
Den negativa elektroden, det vill säga katoden, som tar emot dessa elektroner och genomgår reduktion, är själva materialet som belades. På detta sätt förblir den skyddad även om dess yta bryts på något sätt.
Av Jennifer Fogaça
Examen i kemi
Källa: Brazil School - https://brasilescola.uol.com.br/quimica/eletrolise-com-eletrodos-ativos.htm