det kemiska elementet fosfor (P) tillhör den tredje perioden av det periodiska systemet och till kväve (VA) -familjen. Av denna anledning gör dess atomer normalt tre kemiska bindningar för att nå oktettteori (stabilitet). Det finns dock vissa situationer där en fosforatom gör mer än tre bindningar, ett faktum som bara är möjligt genom hybridiseringsfenomen.
Att förstå fosforhybridisering, vi måste först förstå varför atomen i detta element skapar tre bindningar. För att göra detta, följ bara din elektroniska distribution:

Elektronisk fosforfördelning
Vi kan konstatera att fosforatomen i valensskiktet har det fullständiga 3-delnivån (med två elektroner) och det ofullständiga 3p-undernivån (var och en av de tre p-undernivå-orbitalerna har en elektron). Nedan har vi fördelningen av elektroner i orbitalerna på undernivåerna av Fosforvalensskikt:
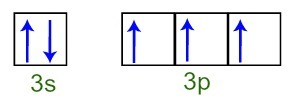
Representation av valensskalelektronerna i fosforatomen
Eftersom var och en av de 3p orbitalerna i subnivå är ofullständig, kan fosforatomen skapa tre kemiska bindningar och därmed uppnå stabilitet.
Nu när vi tittar på ämnet PCl5till exempel är vi säkra på att fosfor i denna molekyl genomgick hybridisering, eftersom den gjorde fem anslutningar. Eftersom klor, som tillhör VIIA-familjen, behöver en bindning för att vara stabil och molekylen har fem atomer av detta element måste var och en av dem göra en bindning, vilket gör att fosforatomen i sin tur också måste göra fem Anslutningar. Denna händelse är endast möjlig via hybridisering (sammanslutning av ofullständiga atomorbitaler) av fosfor.
När man tar emot energi från den yttre miljön blir fosforatommens elektroner upphetsade. Strax efter flyttar en av de två elektronerna som tillhör 3s-undernivån till en tom orbital närvarande i d-undernivån, som tills dess inte har några elektroner. Se diagrammet nedan:
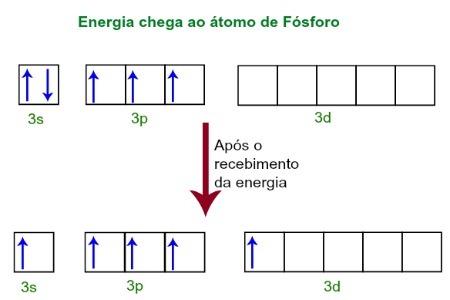
Efter mottagande av energi är fosforelektronerna exciterade och man upptar en omloppsnivå av underundernivån.
För närvarande har vi i fosforens valenslager en s-orbital, tre p-orbitaler och en ofullständig d-orbital.I slutändan hybridiserar dessa fem orbitaler, det vill säga sammanfogar, vilket resulterar i fem ofullständiga atomorbitaler, som nu kan göra fem kemiska bindningar.

Hybridisering av ofullständiga atomorbitaler av fosfor
Eftersom en s-orbital, tre p-orbitaler och en d-orbital förenades, är fosforhybridiseringen av typen sp3d.
Av mig Diogo Lopes Dias
Källa: Brazil School - https://brasilescola.uol.com.br/quimica/hibridizacao-fosforo.htm
