DE stereoisomerism, också känd som Rymdisomerism, är en typ av isomerism där dess isomerer differentieras genom att bindningarna mellan deras atomer arrangeras olika i rymden.
Det finns två typer av stereoisomerer, diastereoisomerer och den enantiomerer. Diastereoisomerer är geometriska isomerer av cis-trans-typen, som inte är spegelbilder av varandra, medan enantiomerer är optiska isomerer som är spegelbilder av varandra.
Pratar lite om cis-trans diastereoisomer, förekommer det bara i föreningar som är omättade eller som är cykliska. Varför förekommer det inte i mättade kedjeföreningar, det vill säga som endast har enstaka bindningar mellan kol?
Det kan hända att vi blir förvirrade och tänker att vissa mättade föreningar är diastereoisomerer, när de i själva verket representerar samma förening. Till exempel nedan har vi tre rumsliga konformationer av atomerna av 1,2-dikloretan:
H H H H H Cl
│ │ │ │ │ │
H — Ç — Ç — H H — Ç — Ç — ClH — Ç — Ç — H
│ │ │ │ │ │
Cl ClCl H Cl H
Är dessa tre diastereoisomerer? Låt bli. Faktiskt,
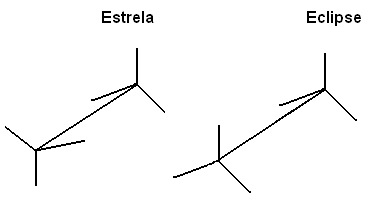
de tre molekylerna är av samma förening. Vad som händer är att enkelbindningarna eller sigma (σ) mellan kol kan genomgå rotation, vilket resulterar i olika atomarrangemang.Se hur detta händer i schemat nedan med etan:

Dessa föreningar, som faktiskt är samma förening, utför inte geometrisk cis-trans-isomerism utan kallas konformationsisomerer, eftersom de bara skiljer sig åt i formen av deras atomer orsakade av rotation runt den enskilda bindningen.
Ett av sätten att representera dessa molekyler för att göra det enkelt att visualisera anslutningsaxelns rotation är genom Newmans projektion, där det betraktas som om synplanet var exakt på axeln för bindningen mellan kolerna och de representeras av en central cirkel. Se Newmans projektion för etan:

Vi kan också representera dessa olika konformationer genom formel på staffli:
Denna fria rotation av länkaxeln sker inte längre i omättade föreningar eller i cykliska. Föreställ dig till exempel att vi bygger en enkel modell som representerar två kol av två isoporbollar som är förbundna med en tandpetare som sitter fast i dem.
När vi har en enda tandpetare och håller en av kulorna kan den andra lätt rotera runt sin egen axel, precis som med enkel bindning.

Men om vi placerar ytterligare en tandpetare som förbinder de två sfärerna kommer vi inte att kunna hålla en sfär och rotera den andra. Om vi gör detta kommer tandpetarna att gå sönder. På samma sätt, när det finns en pi-bindning och en sigma (dubbelbindning) finns det ett hinder för kolernas rotation.
I fallet nedan, där vi har en dubbelbindning mellan kolerna, är det därför inte fråga om två konformationsisomerer, det vill säga två konformationer för samma molekyl; vi har faktiskt två cis-trans diastereoisomerer:
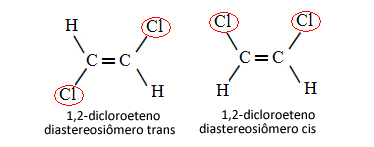
Se mer om denna typ av isomerism i texten Geometriska eller cis-trans-isomerer.
Av Jennifer Fogaça
Examen i kemi
Källa: Brazil School - https://brasilescola.uol.com.br/quimica/isomeria-conformacional.htm