På ämnen är de material med konstant kemisk sammansättning och som har sina fysikaliska egenskaper väldefinierade, såsom smält- och kokpunkter och densitet, varierar inte i vissa temperatur och tryck.
Det destillerade vattnet som används i laboratorier är till exempel ett rent ämne bildas endast av H-molekyler2O (detta är dess konstanta kemiska sammansättning) och under ett tryck på 1 atm (vid havsnivå) kommer den alltid att ha en smältpunkt lika med 0 ° C, en kokpunkt lika med 100 ° C och en densitet på 1,0 g / ml vid 4 ° C. Se ytterligare två exempel:
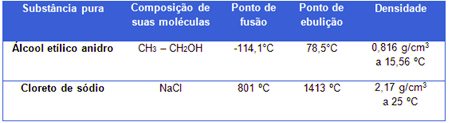
Fysikaliska egenskaper hos alkohol och natriumklorid
Det finns två typer av ämnen, enkla och sammansatta:
De) enkla ämnen
Är de vars molekyler endast bildas av en enda typ av kemiskt element. Elementens atomer kan uppträda i isolerad form, som monoatomiska substanser, eller bilda diatomiska och triatomiska molekyler. Exempel:
Monoatomisk: är fallet med heliumgas (He), a prime gas som verkar isolerat i naturen, och även från järn (Fe) och av aluminium
(Al), vilka är metaller. Se texten Metallisk anslutning att förstå hur atomen i dessa element stannar ihop;Diatomik: syrgas som finns i atmosfärsluft består av molekyler som vart och ett bildas av två syreatomer, O2och vätgasmolekyler bildas av två väteatomer, H2;
Triatomics: O ozongas bildas av tre syreatomer, O3.
B) sammansatta ämnen
Är de vars molekyler, eller joniska kluster, bildas av två eller flera kemiska element eller joner. Vatten, alkohol och natriumklorid, som nämns ovan, klassificeras alla som sammansatta ämnen eller kemiska föreningar, eftersom de består av olika grundämnen (väte, syre, kol, natrium och klor).
Ett annat exempel: koldioxid (CO2), kolmonoxid (CO), metan (CH4) och ammoniak (NH3).
Föreningar kan delas upp i enkla ämnen. Till exempel när vi passerar en elektrisk ström över smält natriumklorid, a redoxreaktion som kommer att ge upphov till två enkla ämnen, metalliskt natrium (Na(s)och klorgas (Cl2 (g)). Denna process är känd som Nedsatt elektrolys av Natriumklorid.
Av Jennifer Fogaça
Examen i kemi
Källa: Brazil School - https://brasilescola.uol.com.br/quimica/substancias-simples-compostas.htm
