Om det var möjligt att visualisera strukturen hos en metall mycket tydligt skulle vi se det som på bilden ovan. Metallernas atomstruktur är kristallin, som består av metallkatjoner omgiven av elektroner.
De kristallina gitter som finns i metaller kan representeras enligt följande: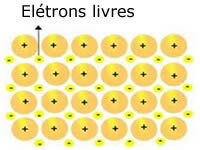
Representation av metalliskt natrium (Na)
De kristallina metallgallerna bildas av en grupp fasta katjoner.
Varje Na + -katjon är omgiven av elektroner, men dessa delokaliseras, det vill säga de lockas inte av någon kärna.
Eftersom det inte finns någon attraktion mellan negativa laddningar (elektron) och den positiva kärnan (katjonen), slutar de fria elektronerna att uppta hela metallens kristallgitter. Friheten som elektroner har att röra sig får dem att bilda ett elektroniskt moln.
Metallernas förmåga att leda elektricitet förklaras av närvaron av detta moln. Elektrisk ström härrör från kontakt med fria elektroner med andra metaller.
I kompositionen av vilken atom som helst, inklusive metaller som natrium (Na), guld Au, koppar (Cu), finns det ett valensskikt. Elektroner rör sig fritt genom detta lager och bibehåller den elektromagnetiska attraktionen för katjoner. Denna strukturella egenskap gör det möjligt att bilda metallmolekyler och följaktligen själva metallerna.
Av Líria Alves
Examen i kemi
Källa: Brazil School - https://brasilescola.uol.com.br/quimica/como-se-forma-ligacao-metalica.htm
