Kapaciteten som anslutningarna har för att locka elektriska laddningar definieras som polaritet, vilket får en annan karaktär beroende på anslutningen där den finns.
De vanligaste bindningarna med organiska föreningar sker mellan kolatomer eller mellan kol- och väteatomer: C ─ C och C ─ H (kolväten). Vi klassificerar denna typ av bindning som kovalent, den finns i alla bindningar av organiska föreningar som endast bildas av kol och väte.
När det i molekylen av en organisk förening finns ett annat kemiskt grundämne förutom kol och väte, kommer dess molekyler att ha en viss polaritet. Vi kallar detta element en heteroatom och det kan vara: kväve (N), syre (O), bland andra.
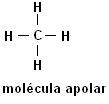
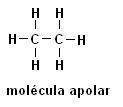
Metan (CH4Etan (C2H6)
Observera att i båda strukturerna finns det ingen närvaro av heteroatomer, i detta fall klassas molekylerna som icke-polära.


Närvaron av syre som en heteroatom gör att molekylerna visar polaritet. Den första molekylen är föreningen Etanol (CH3CH2åh), ger närvaron av hydroxyl-OH denna förening en polär karaktär, även om den i sin struktur innehåller en icke-polär del.
Av Líria Alves
Examen i kemi
Brasilien skollag
Se mer! platt isomer
Organisk kemi - Kemi - Brasilien skola
Källa: Brazil School - https://brasilescola.uol.com.br/quimica/moleculas-organicas-polares-apolares.htm

