I texten "Koncentration i mol / l eller molaritet”Du såg att koncentrationen i mol / L avser mängden materia i det lösta ämnet (n1, mätt i mol) med lösningsvolymen i liter (V). Det finns dock några lösta ämnen som, när de placeras i vatten, genererar joner.
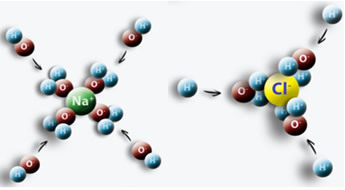
Ett exempel är när vi lägger salt (NaCl) i vatten, en attraktion inträffar mellan den positiva polen i vattnet med Cl och den negativa polen med Na, vilket ger upphov till Na-joner+ och Cl-.
Det är viktigt att veta hur man bestämmer koncentrationen i mol / L av dessa joner, eftersom detta kan vara användbart i många situationer. Ett område som använder detta är medicin, särskilt vid medicinska blodprover. Vårt blod och andra kroppsvätskor har joner upplösta i sig. Om koncentrationen av dessa joner i vårt blod är över eller under det normala kan det äventyra vår kropps funktion och leda till störningar och sjukdomar.
Se fallet med järnjoner (Fe2+): om personen saknar denna jon kan han utveckla anemi. Således, när någon som har anemi får höra att de behöver konsumera järnrika livsmedel eller till och med något läkemedel som innehåller järn, är det faktiskt järnjonen och inte det metalliska elementet.
Ett annat fall är när det finns förlust av kalciumjoner (Ca2+) i ben, vilket orsakar osteoporos, som visas på bilderna med förstorade bilder av ben nedan:

Titta på andra exempel på joner som har vitala funktioner i vår kropp och måste vara i rätt koncentration:

Med tanke på denna information blir det därför uppenbart att det är viktigt att veta hur man beräknar jonkoncentrationen i lösningar. Men hur kan detta göras?
Det är möjligt att bestämma koncentrationerna i mol / L av jonerna som finns i lösningar om två väsentliga data är kända, vilka är:
- Formlerna för ämnen lösta i vatten;
- Molariteten hos dina lösningar.
Med dessa data i handen, skriv dissociations- eller joniseringsekvationen för den lösta ämnet i fråga och hitta genom avdrag koncentrationen av jonerna, som den är proportionell mot antalet mol av varje jon. Detta betyder att koncentrationen av joner är proportionell mot deras respektive koefficienter i joniserings- eller dissociationsekvationen.
Se följande exempel för att bättre förstå hur denna beräkning utförs:
"Tänk på att koncentrationen i kvantitet av en given vattenlösning av magnesiumfosfat (Mg3(DAMM4)2 är 0,5 mol / l. Vad blir koncentrationen i mol / l av magnesiumkatjoner (Mg2+(här)) och fosfatanjoner (PO3-4 (aq)) i denna lösning, med tanke på att graden av dissociation (α) var 100%? "
Det första steget för att lösa detta problem är att skriva dissociations- eller joniseringsekvationen. Om du har svårt kan du basera dig på den generiska ekvationen nedan:
1 AxBy → x A+ y + y B-x
1 mol x mol y mol
Så med tanke på att i detta exempel magnesiumfosfat helt dissocieras har vi följande ekvation:
1 mg3(DAMM4)2 (aq) → 3 mg2+(här) + 2 gp3-4 (aq)
1 mol 3 mol 2 mol
Vi kan se att 1 mol Mg3(DAMM4)2 ger 3 mol Mg2+(här) och 2 mol PO3-4 (aq); sålunda kommer antalet mol av katjonen att vara 3 gånger antalet mol av fosfatet med vilket lösningen bereddes, och det för anjonerna kommer att vara två gånger.
Eftersom lösningen är 0,5 mol / l Mg3(DAMM4)2 (aq) betyder detta att 0,5 mol Mg löstes i 1 liter av det3(DAMM4)2som gav upphov till 1,5 mol / l Mg2+(här) och 1,0 mol / l PO3-4 (aq):
1 mg3(DAMM4)2 (aq) → 3 mg2+(här) + 2 gp3-4 (aq)
1 mol 3 mol 2 mol
0,5 mol x y
1. 0,5 3. 0,5 2. 0,5
0,5 mol / l 1,5 mol / l1,0 mol / l
Men tänk om graden av dissociation eller jonisering inte var 100%? Låt oss säga att det var 70%, hur skulle vi ta reda på mol / L-koncentrationen av dessa joner?
I så fall gör du bara en enkel regel om tre. Se nedan:
1,5 mol / l Mg2+(här) 100 %
x 70%
x = 70. 1,5 → x = 1,05 mol / l Mg-joner2+(här)
100
1,5 mol / l PO3-4 (aq) 100 %
y 70%
y = 70. 1,0 → y = 0,70 mol / L PO-joner3-4 (aq)
100
Av Jennifer Fogaça
Examen i kemi
Källa: Brazil School - https://brasilescola.uol.com.br/quimica/concentracao-dos-ions-mol-l.htm