Lär dig tillämpa termodynamikens första lag i olika situationer, lös övningar och testa dina kunskaper med lösta och förklarade övningar.
fråga 1
Termodynamikens första lag säger att:
a) Energi kan inte skapas eller förstöras, men den kan omvandlas från en form till en annan.
b) Energi är alltid bevarad, men den kan inte omvandlas från en form till en annan.
c) Energi kan skapas eller förstöras, men den kan inte omvandlas från en form till en annan.
d) Energi kan inte bevaras, men den kan omvandlas från en form till en annan.
Termodynamikens första lag är principen om energibevarande, så i ett system stängd förblir energimängden konstant och kan endast omvandlas från en form till en annan. Övrig.
fråga 2
Antag ett slutet system som tar emot 100 J värme samtidigt som man gör 50 J arbete. Vad är förändringen i systemets inre energi?
a) -50 J
b) 0 J
c) 50 J
d) 100J
e) 150J
Kontrollerar skyltarna:
Värmemottaget är positivt Q > 0.
Utfört arbete är positivt W > 0.
Enligt den första lagen har vi:
fråga 3
Ett idealiskt gassystem utbyter 500 joule värme med den yttre miljön. Förutsatt att denna process är en isometrisk kylning, bestäm arbetet respektive intern energi.
a) 500 J och 0 J
b) - 500 och 0 J
c) O J och 500 J
d) 0 J och -500 J
e) -500 J och 500 J
Eftersom processen är isometrisk sker ingen förändring i volym, så arbetet är noll.
Enligt termodynamikens första lag:
Eftersom det är en kylning förlorar systemet värme, därför:
fråga 4
8 mol av en idealisk gas i ett kolv-cylindersystem komprimeras genom att utföra 1000 J arbete. Under processen förloras 400 J värme till den yttre miljön. Dess inre energi och förändringen i dess temperatur är respektive lika med
Givet: R = 8,31 J/mol. K
a) - 1400 J och ungefärlig variation på 6 K
b) 600 J och ungefärlig variation på 6 K
c) 600 J och ungefärlig variation på 14 K
d) - 1400 J och ungefärlig variation på 14 K
inre energi
När systemet tar emot arbete är dess tecken negativt, liksom värmen, som i denna process går förlorad.
Termodynamikens första lag är:
Genom att ersätta värdena får vi:
R = 8,31 J/mol K
Temperatur
Enligt Joules lag har vi:
fråga 5
En perfekt gas genomgår kompression och gör 500 J arbete. I slutet av denna transformation förändrades systemets inre energi 200 J mindre än i början. Mängden värme som utbyttes av gasen var
a) - 700 J
b) - 300 J
c) 300J
d) 0J
e) 700 J
Eftersom arbetet mottogs, det vill säga motståndskraftigt arbete, är dess tecken negativt.
Ersätter värdena i ekvationen för termodynamikens första lag:
fråga 6
(CEDERJ 2021) I ett skede av cykeln som utförs av en idealisk gas i en luftkonditionering, ökas gastrycket för att hålla dess volym konstant. I detta skede av cykeln är arbetet W utfört av gasen, mängden värme Q som absorberas av den och förändringen ΔT i dess temperatur, respektive:
a) W < 0, Q < 0 och ΔT < 0
b) W = 0, Q > 0 och ΔT > 0
c) W = 0, Q = 0 och ΔT = 0
d) W > 0, Q > 0 och ΔT > 0
Data:
Trycket P ökar;
Volymen förblir konstant;
Arbete
Eftersom volymen är konstant är arbetet W lika med noll.
Termodynamikens första lag lyder så här:
Eftersom värme är positivt kommer förändringen i inre energi också att vara positiv.
Värme
Eftersom värme absorberas är den positiv.
Temperatur
Enligt gaslagen:
Var,
n är antalet mol
R är den universella gaskonstanten
Temperaturen beror alltså endast på trycket, eftersom volymen är konstant och är positiv.
fråga 7
(UNICENTRO 2018) Enligt termodynamikens första lag är förändringen i den inre energin i ett system, ΔU, ges av skillnaden mellan värmen som utbyts med den yttre miljön, Q, och arbetet, W, som utförs i processen termodynamisk. Med tanke på denna information, om en monoatomisk gas expanderar så att den alltid förblir vid samma temperatur, kan denna omvandling representeras av ekvationen
a) ΔU + W = 0
b) ΔU − W =0
c) Q − W = 0
d) Q + ΔU = 0
Isotermisk process sker utan temperaturförändring.
Energi relateras till temperatur genom:
Där n är antalet mol och R är den universella gaskonstanten. Eftersom n och R är konstanta finns det bara temperaturvariationer, och
Termodynamikens första lag lyder så här:
fråga 8
(URCA 2016) Enligt termodynamikens första lag om gasen frigörs under en isoterm process som genomgår en idealgas med fast massa en mängd värme vars magnitud är 50 cal då förändringen i inre energi och det arbete som utförs av gasen i denna process är, respektive:
a) 0 och 50 kal.
b) 50 cal och 0.
c) 0 och 0.
d) 50 cal och -50 cal.
e) O och -50 kal.
Förändringen i intern energi är direkt relaterad till förändringen i temperatur. Eftersom processen är isoterm, sker ingen temperaturförändring, så .
Från termodynamikens första lag:
Eftersom värme frigörs är dess tecken negativt.
fråga 9
(UFRN 2012) Biomassa är en av huvudkällorna till förnybar energi och därför är maskiner som använder den som bränsle för elproduktion viktiga ur miljösynpunkt. Ett mycket vanligt exempel är användningen av biomassa för att driva en ångturbin för att generera arbete. Bilden på sidan visar schematiskt ett förenklat termoelektriskt kraftverk.
I denna termoelektriska anläggning producerar förbränning av biomassa i ugnen värme, som värmer vattnet i pannan och genererar högtrycksånga. Ångan leds i sin tur genom rör till turbinen som under dess verkan börjar rotera sina blad.
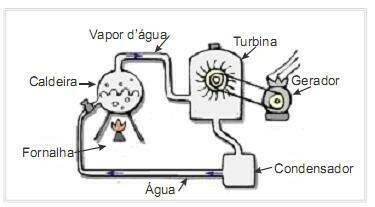
Antag att värmeförlusterna på grund av temperaturskillnader mellan delarna i denna värmemotor och miljön är försumbara. I detta sammanhang variationen i pannvattnets inre energi
a) är större än summan av den värme som tillförs den genom förbränning av biomassan och det arbete som utförs på turbinen.
b) är lika med summan av värmen som tillförs den genom att förbränna biomassan med det arbete som utförs på turbinen.
c) är lika med skillnaden mellan den värme som tillförs den genom förbränning av biomassan och det arbete som utförs på turbinen.
d) är större än skillnaden mellan den värme som tillförs den genom förbränning av biomassan och det arbete som utförs på turbinen.
Vattnet i pannan får energi i form av värme från förbränning av bränslet och frigör energi i form av arbete som utförs på turbinen.
fråga 10
(UECE 2021) Beträffande egenskaperna hos gaser, var uppmärksam på följande uttalanden:
i. För en idealgas är intern energi enbart en funktion av trycket.
II. Värmen som absorberas av en gas när den ändrar dess tillstånd är oberoende av processen.
III. Den inre energin hos en idealgas är enbart en funktion av temperaturen och är oberoende av processen.
IV. I en isotermisk expansion av en idealgas är arbetet som utförs av den lika med värmen som absorberas.
Det är korrekt vad som står endast i
a) I och II.
b) III och IV.
c) I och IV.
d) II och III.
III. KORREKT. Den inre energin hos en idealgas är enbart en funktion av temperaturen och är oberoende av processen.
Förändringen i intern energi är direkt relaterad till förändringen i temperatur.
Där n är antalet mol och R är den ideala gaskonstanten, eftersom det är konstanter, är det bara temperaturen som bestämmer gasens inre energi.
IV. KORREKT. I en isotermisk expansion av en idealgas är arbetet som utförs av den lika med värmen som absorberas.
Eftersom det är isotermiskt sker ingen temperaturförändring, så förändringen i intern energi är noll. Enligt termodynamikens första lag:
Lär dig mer med:
- Termodynamikens första lag
- Termodynamik: lagar, begrepp, formler och övningar
- Övningar om termodynamik
- gaslagen
ASTH, Rafael. Övningar av termodynamikens första lag.All Matter, [n.d.]. Tillgänglig i: https://www.todamateria.com.br/exercicios-da-primeira-lei-da-termodinamica/. Tillgång på:
Se också
- Övningar om termodynamik
- Termodynamik
- adiabatisk transformation
- Övningar om termokemi
- Termodynamikens första lag
- Naturvetenskap och deras teknologier: Enem
- Värmeenergi
- Termodynamikens andra lag

