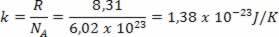Entalpi är mängden energi i en given reaktion, vi kan beräkna ett systems värme genom förändringen i entalpi (∆H).
∆H i fysiskt tillstånd förändras: 
Figuren representerar en förändring i fysiskt tillstånd från fast till flytande (smältande). Det inträffar när vatten genomgår en entalpi av fusion: is som smälter till följd av en absorption av värme. Mängden värme som behövs för att denna process ska inträffa är 7,3 KJ / mol (fusion av 1 mol H2Du)). Processekvation:
H2O (s) → H2(1) ∆H = + 7,3 KJ / mol
Var nu uppmärksam på bilden nedan:
Lägg märke till ångan som kommer ut ur vattenkokaren, den visar en förändring i det fysiska tillståndet. Vattnet inne i vattenkokaren var i flytande tillstånd, men på grund av värmeabsorptionen ändrades det till ett gasformigt tillstånd. Värmen som krävs för förångningens entalpi uppträder i 1 mol H2O (1) är 44 KJ / mol, enligt ekvationen:
H2O (1) → H2V) ∆H = + 44 KJ / mol
Av Líria Alves
Examen i kemi
Brasilien skollag
Fysikalisk-kemisk - Kemi - Brasilien skola
Källa: Brazil School - https://brasilescola.uol.com.br/quimica/entalpia-nas-mudancas-estado-fisico.htm