DE hassium, med symbolen Hs och atomnummer 108, är ett av de element som kallas transaktinider. Liksom alla element i denna grupp finns den inte i naturen, eftersom den är syntetisk, förutom att den är radioaktiv och instabil. Dess syntes krediteras de tyska laboratorierna vid Helmholtz Center for Research on Heavy Ions (GSI), i staden av Darmstadium, Tyskland, och dess namn gavs för att hedra den tyska delstaten Hessen, som ligger i den centrala regionen föräldrar.
Hassium är det tyngsta grundämnet för att få sina egenskaper analyserade, genom experiment utförda av GSI själv. Resultaten var viktiga för att bekräfta positionen för Hs i Periodiska systemet, eftersom likheten mellan detta grundämne och osmium och rutenium, lättare grundämnen i grupp 8, uppfattades.
Läs också:Bohrium — det syntetiska kemiska elementet uppkallat efter Niels Bohr
Hassium Sammanfattning
Det är ett syntetiskt kemiskt element som finns i grupp 8 i det periodiska systemet.
Det syntetiserades av Gesellschaft für Schwerionenforschung (GSI) i Darmstadium, Tyskland.
Det är en radioaktivt element och instabil.
Teoretiska och experimentella data bekräftar att dess egenskaper liknar de lättaste elementen i sin grupp.
Som en transaktinid kan den inte produceras i stor skala, annat än att den produceras i en takt av ett fåtal atomer.
Hassium egenskaper
Symbol: hs
Atomnummer: 108
Atomisk massa: 277 c.u.
Elektronisk konfiguration: [Rn] 7s2 5f14 6d6
Mest stabila isotopen: 269Hs (14 sekunders halveringstid)
Kemisk serie: grupp 8; transaktinider; supertunga element.
Hassium funktioner
Hassium är en syntetiskt element och den tyngsta i grupp 8. Det anses vara en transaktinid, just för att det förekommer i det periodiska systemet efter aktinidserien. Som alla transaktinider är hassium ett grundämne radioaktiva och instabila.
Detta innebär att dess isotoper når lite tid halva livet (den tid som krävs för att massan av atomarten ska minska till hälften). För närvarande är sju isotoper av hassium kända, vars massa varierar från 264:00 till 270:00. Bland alla är den mest stabila isotopen 269Hs, med en halveringstid på 14 sekunder.
Även om den korta halveringstiden gör det svårt att studera de kemiska egenskaperna hos transaktinider, har hassium haft lite mer tur i detta avseende. I juni 2001 meddelades att han hade blivit det tyngsta elementet för att få sina egenskaper analyserade.
Ett team lyckades, i staden Darmstádio, Tyskland, producera cirka sex Hs-atomer med en halveringstid på cirka 10 sekunder. Även om det verkar lite, var detta tillräckligt för att bekräfta att hassiumoxiden, HsO4, har starka likheter med oxiderna av de lättare grundämnena i grupp 8, RuO4 och OsO4, det är rutenium det är osmium.
Se också: Seaborgium — ett annat syntetiskt kemiskt grundämne med radioaktiva egenskaper och kort halveringstid
Skaffa Hassium
Gemensamt för transaktinider är svårigheten att produceras. Generellt krävs toppmodern utrustning som t.ex partikelacceleratorer. I dessa kolliderar joniska arter med element av hög atomisk massa att bilda de supertunga elementen (i vilka Hs ingår).
När det gäller hassium involverade studierna som bekräftade dess position i grupp 8 i det periodiska systemet dess produktion genom bombardemang av magnesium-26, med curium-248 som mål.
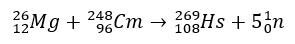
Experiment som involverar dessa grundämnen är dyra, och därför är det vanligt att teoretiska studier utförs, just för att beräkna och förutsäga kemiska egenskaper. Den korta halveringstiden är en annan komplicerande faktor.
De experimentella teknikerna för separation och detektering måste gå mycket snabbt för att trovärdiga resultat ska kunna produceras. Slutligen är reaktionseffektiviteten för dessa element mycket låg, och ligger inom intervallet några få atomenheter.
Försiktighetsåtgärder med Hassium
Hs produceras inte i stor skala, och därför dess manipulation inte innebär några risker. Dessutom erhålls den i forskningscentra med mycket kontrollerade miljöer.
hassiums historia

Transaktiniderna var protagonister i en vetenskaplig tvist på grund av Kalla kriget, a Överföringskrig, ett namn myntat med hänvisning till de tvister som involverade produktion och igenkänning av grundämnen efter fermium (Fm, Z = 100). I detta lopp var laboratorierna involverade:
Joint Institute for Nuclear Research, i staden Dubna, Ryssland;
Lawrence Berkeley National Laboratory i Berkeley, Kalifornien;
Gesellschaft für Schwerionenforschung (GSI, bättre översatt som Helmholtz Center for Research on Heavy Ions) i Darmstadium, Tyskland.
I fallet med element 108 var GSI- och Dubna-grupperna inblandade. Men även om Dubna-forskarna (ledda av Yuri Oganessian) först rapporterade närvaron av element 108, tog de från den tyska gruppen åt sig äran, som GSI presenterade mer övertygande resultat, medan han i ett experiment lyckades producera tre atomer av isotopen 265, medan han i ett annat producerade en atom av isotopen 264.
Dessa isotoper producerades med hjälp av Universal Linear Accelerator (Unilac, bättre översatt som Universal Linear Accelerator), med bombardemang av 208Pb av 58Tro. 1997 erkände International Union of Pure and Applied Chemistry (IUPAC) element 108, med symbolen Hs, som Hassium för att hedra den tyska delstaten Hessen.
Övningar lösta på hassium
fråga 1
Hassium, symbolen Hs, anses vara det tyngsta grundämnet som har sina egenskaper studerade experimentellt. Vid den tiden kunde forskare fastställa egenskaperna hos hasiumtetroxid, HsO4. Hos denna art har Hs samma NOx som de lättare elementen i sin grupp, osmium (Os) och rutenium (Ru). Oxidationstalet för Hs i hasiumtetroxid är lika med:
a) 0
B) +2
C) +4
D) +6
E) +8
Upplösning:
Alternativ E
DE syre, när i en oxid, får en laddning lika med -2. Alltså NOx av Hs, som vi kommer att kalla x, kan beräknas som:
x + 4(-2) = 0
x - 8 = 0
x = +8
fråga 2
Den mest stabila isotopen av hassium, Hs, har en halveringstid på bara 14 sekunder. Det betyder:
A) på 14 sekunder kommer massan av isotopen av Hs att ha fördubblats.
B) efter 14 sekunder kommer massan av Hs-isotopen att vara mindre än hälften av den initiala massan.
C) på knappt en minut kommer massan av Hs-isotopen att vara 1/16 av dess initiala massa.
D) på en minut kommer massan av Hs-isotopen att vara exakt hälften av dess initiala massa.
E) på 14 sekunder kommer massan av Hs-isotopen att delas med 4.
Upplösning:
Alternativ C
Halveringstiden anger den tid som krävs för att mängden atomslag ska halveras. Detta innebär att mängden Hs sjunker med hälften var 14:e sekund. Genom att observera denna halveringstid är det tydligt att med 56 sekunder har fyra halveringstider redan uppnåtts, vilket gör att massan av Hs delas med 24, vilket är 16.
Av Stefano Araújo Novais
Kemilärare

