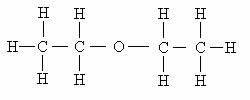
DE isomeri det är ett fenomen som observeras när olika föreningar bildas av lika mängder av samma typer av atomer.
Därför kan vi hitta kemiska ämnen med samma molekylformel och olika strukturformler eller rumsliga arrangemang.
Detta fenomen är allmänt observerat inom organisk kemi, som studerar kolföreningar. Eftersom varje atom i detta element kan göra 4 kemiska bindningar, är det möjligt att observera olika kombinationer.
Eftersom förändringen i arrangemanget av atomer ger upphov till nya ämnen, har de följaktligen olika fysikaliska och kemiska egenskaper.
När vi säger vilka föreningar som är isomerer betyder att de har lika delar, eftersom ordet är en kombination av två termer med grekiskt ursprung: isos, betyder "på riktigt", och ren, som är "delar".
De två huvudgrupperna av isomerism är plan och rymd (stereoisomerism).
DE platt isomerism den kan visualiseras av föreningarnas platta strukturformel och har fem klasser: position, funktion, kedja, kompensation och tautomeri.
DE rymdisomerism det observeras av föreningarnas orientering och är uppdelat i geometrisk (cis-trans) och optisk.
Begreppet isomerism introducerades 1830 av den svenske vetenskapsmannen Jacob Berzelius.
Exempel på isomerer
DE kedjeisomerism det uppstår när samma uppsättning atomer ansluter för att bilda strukturer av samma funktionella grupp, men med olika kedjor.
Exempel: molekylformeln C4H10 av ett kolväte kan vara rakt eller grenat.

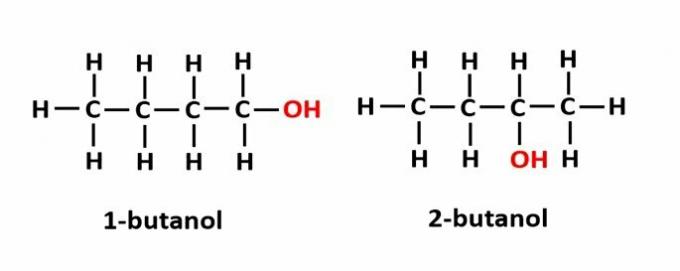
DE position isomerism uppstår när föreningar bildas av samma funktionella grupper, men de befinner sig på olika positioner i kedjan.
Exempel: Molekylformeln C4H9OH motsvarar två typer av alkohol.
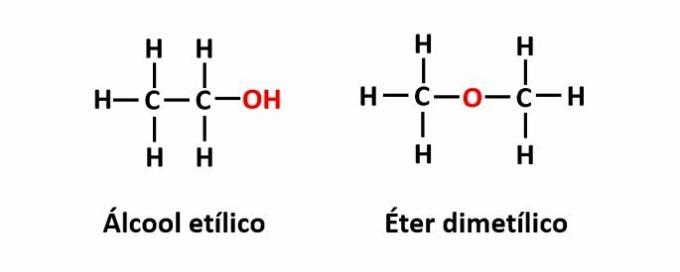
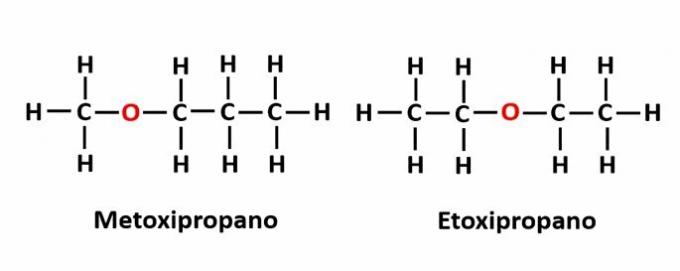
DE funktion isomerism uppstår när samma molekylformel motsvarar två föreningar med olika funktionella grupper.
Exempel: Molekylformeln C2H6O motsvarar två isomerer som har funktionerna alkohol (-OH) och eter (-O-).
DE kompensationsisomerism det uppstår när det finns en heteroatom i kedjan och den intar olika positioner. Detta är ett särskilt fall av positionsisomerism.
Exempel: Molekylformeln C4H10Den indikerar närvaron av en syreatom i kedjan, men dess position kan förändras och bilda olika föreningar.
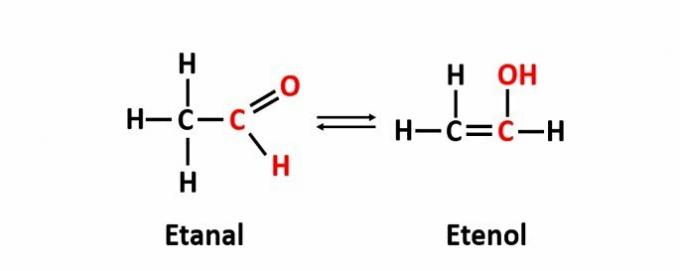
DE dynamisk isomerism, även kallad tautomeri, uppstår när två föreningar med olika funktioner är i samma lösning i dynamisk jämvikt. Detta är ett särskilt fall av funktionsisomerism.
Exempel: Molekylformeln C2H4O motsvarar föreningar med aldehyd- och enolfunktionerna.
Lära sig mer om platt isomerism.
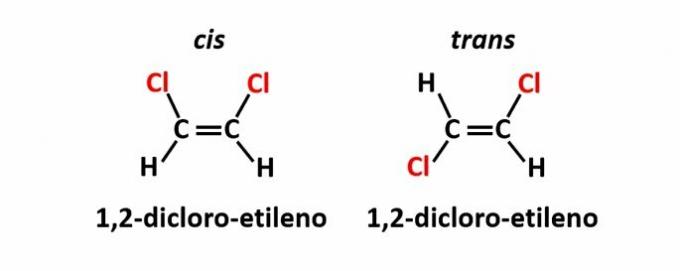
DE geometrisk isomerism, även kallad isomeri cis-trans, inträffar när närvaron av en dubbelbindning eller cyklisk struktur gör att lika ligander finns på samma sida av planet (cis) eller på motsatta sidor (trans).
Exempel: kloratomerna i föreningar med molekylformel C2H2Cl2 de kan ha två rumsliga strukturer.
DE optisk isomerism uppstår när föreningarna, när de avböjer det polariserade ljuset som sänds ut på strukturen, lyckas avleda strålen lysande till vänster, om det är en vänstervridande (l) isomer, eller till höger, när det är en vänstervridande isomer (d).
Exempel: Denna typ av isomerism uppstår med mjölksyra. Notera nedan att spektralbilderna av isomererna inte överlappar varandra, därför kallas de enantiomerer.
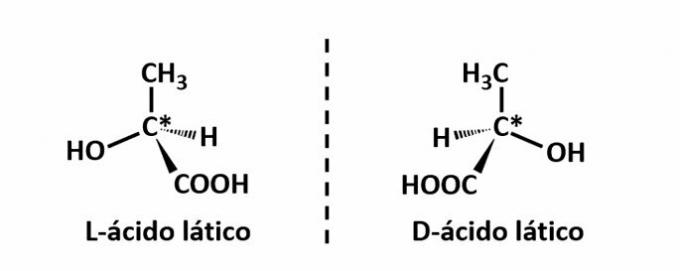
Symbolen C* indikerar närvaron av ett kiralt kol i denna struktur, dvs en kolatom med 4 olika länkar.
Lär dig mer om isomerism med innehållet:
- Typer av isomerism
- rymdisomer
- geometrisk isomer
- optisk isomer
- Övningar om plan isomerism