Ju högre temperatur, desto större är reaktionshastigheten.
Detta kan lätt ses i många situationer i vårt dagliga liv, som i följande exempel:
- När vi vill sakta ner matens sönderdelningsreaktion sänker vi temperaturen och lägger den i kylen.

- Om vi vill påskynda matens reaktion, lägg bara den i en gryta. tryck, vilket med ökande tryck också ökar koktemperaturen för det flytande vatten i vilket mat är;

- Bränder är i allmänhet vanligtvis förödande eftersom temperaturen i omgivningen ökar, vilket orsakar en ökning av förbränningsreaktionens hastighet;
- För att sakta ner metaboliska kemiska processer, vilket minskar risken för hjärnskador på grund av syrebrist utförs vissa operationer genom att sänka patientens kroppstemperatur och förbli omkring 15 ° C;
- Om vi lägger en brusetablett i ett glas varmt vatten och en annan i ett glas kallt vatten, löses den första mycket snabbare.
Men vad förklarar temperaturens direkt proportionella påverkan på reaktionshastigheten?
Detta beror på, som förklaras i texten “
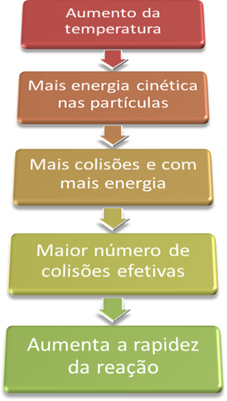
Villkor för förekomst av kemiska reaktioner”, För att en reaktion ska fortsätta, är det nödvändigt att uppfylla vissa villkor, såsom att partiklarna de måste kollidera effektivt och med den minsta energi som krävs, som kallas aktiveringsenergi.Således, när vi ökar temperaturen i systemet, ökar vi också omrörningen av de reagerande partiklarna och ger dem mer kinetisk energi. Med detta kommer fler kollisioner att inträffa och med mer energi, vilket ökar mängden partiklar som kommer att reagera och därmed ökar reaktionshastigheten.
Av Jennifer Fogaça
Examen i kemi
Källa: Brazil School - https://brasilescola.uol.com.br/quimica/temperatura-velocidade-das-reacoes.htm
