Nitrater är oorganiska föreningar som innehåller anjonen NO3-.
Kväve är familj 15, har 5 elektroner i valensskalet och behöver göra tre kovalenta bindningar (med delande elektroner) att ha åtta elektroner i valensskalet och därmed ha stabil. Varje syre har dock 6 elektroner i det sista skalet och därför måste var och en av dess atomer göra två bindningar för att vara stabila.
Så i nitratanjonen är kväve det centrala elementet, som gör en dubbelbindning med ett av syrgaserna, som är stabil, en enkelbindning med ett av de andra två syrgaserna, och med det andra en kovalent bindning dativ. Detta betyder att ett av syrgaserna inte är stabilt, behöver ta emot 1 elektron till, vilket ger en total laddning lika med -1. Med dativen gör kväve en bindning mer än den skulle kunna göra, donerar en av dess elektroner och får en laddning lika med +1. Se nedan strukturen för denna anjon:
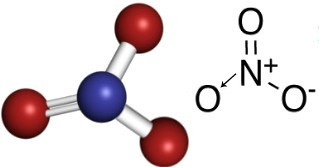
Denna anjon kan ta emot en elektron och bilda en elektriskt neutral förening, ett oorganiskt salt. Dessa föreningar är alla lösliga i vatten.
De huvudsakliga användningsområdena för nitrater är i läkemedel, såsom kärlvidgande medel vid behandling av angina pectoris (smärta i orsakas av låg syretillförsel genom blodflödet till hjärtmuskeln) och erektil dysfunktion manlig. De används också i gödningsmedel och sprängämnen, vilket kommer att nämnas senare.
Nitrater kan produceras genom en neutraliseringsreaktion med salpetersyra (HNO).3) med någon grund. Se exemplet nedan, där magnesiumnitrat bildades:
HNO3 + Mg(OH)2 → Mg (NEJ3)2+ H2O
Tre huvudexempel på denna typ av förening är natriumnitrat (NaNO3), kaliumnitrat (KNO3) och ammoniumnitrat (NH4VID3). I alla dessa fall är katjonerna (Na+,K+ och NH4+) ger 1 elektron till en nitratanjon. Men i verkligheten attraherar dessa motsatta laddningar varandra och bildar väldefinierade jonkluster, som är kristallgittren. Således är nitrater vanligtvis kristallina fasta ämnen, som visas nedan när det gäller natriumnitrat:
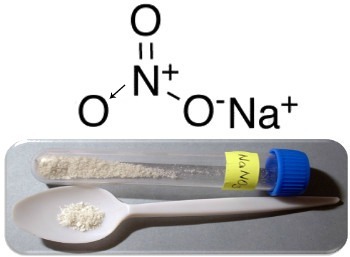
Denna förening används vid tillverkning av gödningsmedel, men den är främst känd som Chilensk salpeter, eftersom det finns stora avlagringar av det i de chilenska öknarna. Det omvandlas till kaliumnitrat, som används för att göra svartkrut som används i olika vapen och sprängämnen.

Både natriumnitrat och kaliumnitrat kallas "saltpeter", och används ofta som konserveringsmedel av färgen på konserverat och rökt kött, samt i vissa livsmedel för att ge en större känsla av mättnad. Emellertid orsakar dess konsumtion allvarliga skador på hälsan, eftersom dessa nitrater kan omvandlas av bakterier från organism till nitriter och senare till nitrosaminer, som är cancerframkallande, främst orsakar cancer i mage. Nitriter omvandlar också hemoglobinerna i blodet, vilket gör dem oförmögna att transportera syre.
De främsta orsakerna till överskottsintag av nitrater är användningen av kvävegödselmedel vid odling av grönsaker.
Salpeter är också farligt eftersom det ökar koncentrationen av natriumjoner i kroppen, vilket kan orsaka hjärtproblem som högt blodtryck.
O ammoniumnitrat den används också som gödningsmedel och sprängämne och användes till och med med eldningsolja i terrorattacken mot World Trade Center-byggnaderna den 11 september 2001.

Attacken mot World Trade Center använde ammoniumnitrat*
* Bildens upphovsrätt: Dan Howell och Shutterstock.com
Av Jennifer Fogaça
Examen i kemi

