På förbränningsreaktioner de är närvarande i många aspekter av vårt dagliga liv. Till exempel är de huvudsakliga energikällorna resultatet av förbränning eller förbränning av vissa bränslen, såsom etanol, bensin, träkol, bland annat. Dessutom är energin vi behöver för att överleva och arbeta resultatet av förbränningsreaktioner som sker inuti våra celler när vi "bränner" maten vi äter.
Men vad krävs för att få en förbränningsreaktion?
Tre saker behövs:
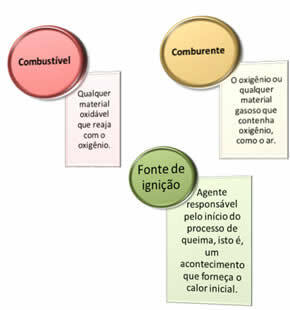
Dessa tre faktorer utgör eldtriangel, för när förbränningsreaktionen väl börjar, upprätthåller den frigjorda energin reaktionen och låter den fortsätta tills bränslet, oxidationsmedlet eller värmen (frigjord energi) är borta. Det betyder att det kommer att finnas en Kedjereaktion.
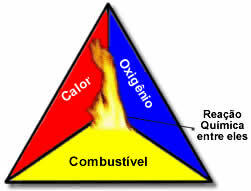
Till exempel, om någon kastar en tänd cigarett i en skog blir det en brand (förbränningsreaktion). I det här fallet buske det är bränsle, O syre som finns i luften atmosfärisk är den oxidationsmedel det är cigarett tänd var antändningskälla. Denna förbränning kommer att fortsätta tills en av de tre faktorerna är eliminerad. Om brandmän kastar vatten kommer värmen att elimineras. Men även om inget görs för att stoppa denna förbränning kommer den att sluta någon gång, det vill säga när bränslet (skogen) tar slut.
Som redan nämnts frigörs värme vid dessa reaktioner, så förbränning är en exoterm reaktion. Denna typ av reaktion är dock ofullständig förbränning. För att förstå varför, se skillnaden mellan fullständig och ofullständig förbränning:
Fullständig förbränning:
Genom att analysera organiska föreningar som bränslen måste vi:
| DE fullständig förbränning det kommer att inträffa när kolkedjan bryts och alla kolatomer i kolkedjan är helt oxiderade. |
| Du formade produkter av kolväten kommer att vara CO2 (koldioxid) och H2O (Vatten). |
Observera den fullständiga förbränningen av isooktan, som är en av komponenterna i bensin.
Ç8H18(g) +25/2 O2 (g) → 8 CO2(g) + 9 timmar2O(1)
ofullständig förbränning
| I det här fallet finns det inte tillräckligt med oxidationsmedel, det vill säga tillräckligt med syre för att bränna allt bränsle. |
| Sålunda är de bildade produkterna CO (kolmonoxid) och H2O. |
Observera samma förbränning av isoktan, men nu ofullständigt:
Ç8H18(g) + 17/2 O2(g) → 8 CO (g) + 9 timmar2O(1)
Bränning av skog är ett exempel, eftersom de resulterande utsläppen består av CO och särskilt material, såsom sot (C), samt aska och andra enkla och komplexa organiska föreningar. Kväveoxid, ozon och aldehyder kan också bildas som ett resultat av sekundära reaktioner på grund av närvaron av andra komponenter i luften.
Ç8H18(g) + 9/2 O2 (g) → 8C (g) + 9 timmar2O(1)
Av Jennifer Fogaça
Examen i kemi
Brasilien skollag
Källa: Brasilien skola - https://brasilescola.uol.com.br/quimica/combustao-completa-incompleta.htm
