DE pastaatom, som namnet antyder är det massan av en atom, vanligtvis symboliserad med "mDe” eller ”MA”. Men eftersom atomen är en extremt liten enhet, osynlig för mänskliga ögon, är det inte möjligt att mäta dess massa med hjälp av till exempel skalor. Så vetenskapsmän bestämde massan av atomer genom att jämföra dem med massorna av andra atomer.
Detta görs även med de andra enheterna. Till exempel är massenheten standardkilogrammet, vilket motsvarar en cylinder 3,917 cm i höjd och diameter, gjord av 10% iridium och 90% platina. Så det fungerar som en jämförelse. Till exempel, om vi "väger" ett föremål på en våg och vi finner att dess massa är 10 kg, betyder det att dess massa är 10 gånger större än den valda standarden: 1 kg.
Detsamma gäller atomer. Standarden som valdes var kol-12, och denna atom tilldelades godtyckligt en massa på 12 u. "u" är enheten för atommassa och motsvarar därför 1/12 massan av en kolatom.
Till exempel, när vi säger att atommassan för väte är lika med 1 u, betyder det att det är som om om vi delar upp kolet i 12 delar är massan av en av dessa delar ekvivalent med massan av atomen i väte. Ett annat exempel är svavel, dess atommassa är 32 u, vilket betyder att dess massa är 32 gånger större än 1/12 av massan av
12Ç.1 u = 1/12 av massan av 1 kolatom 12

Atommassenheten är 1/12 av massan av kol-12
Ämnes molekylmassa är summan av grundämnenas atommassa. Till exempel är syrgas atommassa lika med 16 u, så molekylmassan för syrgasmolekylen (O2) är lika med 32u.
Eftersom laboratorietekniker för närvarande är mycket avancerade finns det anordningar som exakt mäter grundämnenas atommassa, som masspektrometern. Det är alltså möjligt att veta det 1 u är lika med 1,66054. 10-24 g.
Mind Map: Atomic Mass

*För att ladda ner tankekartan i PDF, Klicka här!
Eftersom atommassorna bestäms med stor precision ges de i det periodiska systemet i form av decimaltal. Men när vi ska göra beräkningarna använder vi vanligtvis det avrundade talet, med undantag för experiment som behöver vara mycket exakta. Om du till exempel tittar på det periodiska systemet kommer du att se att atommassan av syre är lika med 15 999 u, men vi använder i allmänhet värdet 16 u i beräkningarna. Detta händer också med kol, vars atommassa ges av 12,01 u, som visas nedan:
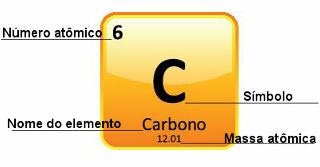
Representation av kol i det periodiska systemet
De grundämnen som förekommer i det periodiska systemet är faktiskt det viktade medelvärdet av alla grundämnets naturliga isotoper. Således är atommassan som visas i tabellen också genomsnittet av atommassorna för dessa element. Till exempel har klor (C?) två naturliga isotoper, 35 och 37, vars respektive procenttal i naturen är 75,76 % och 24,24 %. Atommassorna för var och en av dessa isotoper är olika, där den för Cy-35 är 34,96885 u och den för Cy-37 är 36,96590.
På detta sätt beräknas grundämnets atommassa med hänsyn till massan av varje isotop och det överflöd med vilket det uppträder i naturen. När det gäller klor har vi:
Atommassa för grundämnet klor = (34,96885. 75,76%) + (36,96590. 24,24%)
100%
Atommassa för grundämnet klor = 35,45
Detta är atommassavärdet för klor som visas i det periodiska systemet.
* Mind Map av Me Diogo Lopes
Av Jennifer Fogaça
Examen i bokstäver
Källa: Brasilien skola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-massa-atomica.htm
