Reaktionerna från tillägg är viktiga åtgärder med avseende på organiska synteser, eftersom genom dem kan ett intressant antal organiska ämnen utvecklas.
För att additionsreaktionen ska inträffa är det nödvändigt att skapa två bindningsställen i kolkedjan, vilket helt enkelt sker när kedjan är omättad (närvaro av pi länk). Således, när pi-länken är bruten, visas webbplatserna i kedjan.
En grupp av ämnen som kan användas utöver synteser är cykloalkaner eller cyklaner, grupp av kolväten med cykliska och mättade kedjor. De slipper den allmänna regeln om addition eftersom de inte har en pi-länk, men beroende på vissa förhållanden (värme, katalysatormetall, surt medium) de kan genomgå ett kedjebrott mellan två kolatomer, vilket gör att två bindningsställen uppstår för tillsatsen. Det finns dock ett faktum som begränsar användningen av dessa föreningar. Faktum är samtalet ring stress teori, föreslagen av Adolf V. Bayer 1885.
För att sigmabindningen mellan kolen ska brytas måste det finnas en viss instabilitet mellan kolen. Denna instabilitet är relaterad till vinkeln för bindningar mellan kol. Enligt Bayer är vinkeln som ger en
stor stabilitet för sigma-länken är 109,47O. Alltså kedjor som har en vinkel mellan kolen mindre än 109,47O de tenderar att ha instabilitet i sigmabindningarna mellan kolen som bildar kedjorna, vilket gynnar deras brott kopplat till ett idealiskt yttre tillstånd.De enda cykloalkanerna som har en vinkel mindre än 109,47O bland dess kol är cyklopropan (60Ocyklobutan (90O) och cyklopentan (108O). Cyklopentan har en vinkel mycket nära 109,47O den har mycket stabila sigmabindningar, därför kan den inte genomgå någon additionsreaktion. Nedan har vi strukturerna för dessa tre cykloalkaner:

Strukturformel för cyklopropan, cyklobutan respektive cyklopentan
Observation: Varje cykloalkan som har mer än 5 kolatomer i kedjan kommer att utföra en substitutionsreaktion för exempel, och aldrig ett tillägg eftersom sigmabindningarna mellan deras kolatomer är extremt stabil.
De additionsreaktioner som kan ske med cykloalkaner är i princip alla, men med cyklopentan är de enda som den kan genomgå hydrering och halogenering. Nedan finns exempel på tillsatser med cykloalkaner och deras förhållanden:
a) Hydrogenering
Reaktion av cykloalkanen med vätemolekylen med närvaro av pulverformig metallkatalysator (zink, nickel eller platina) i närvaro av uppvärmning (cirka 180°COÇ). I denna reaktion kommer cykloalkanen att ge upphov till a alkan. I denna reaktion, efter att cykeln har brutits, tillsätts en väteatom till vart och ett av kolen i sigmabindningen som bröts.

Tillsatsreaktion i cyklobutan med användning av väte
b) Halogenering
Reaktion av cykloalkanen med halogenmolekylen (klor, brom, jod, till exempel) med närvaron av järn III-kloridkatalysator (FeCl)3). I denna reaktion kommer cykloalkanen att ge upphov till a organisk halogenid med två halogenatomer i kedjan. Efter att cykeln har brutits har vi tillägg av en halogenatom på vart och ett av kolen i sigmabindningen som bröts.

Tillsatsreaktion i cyklobutan med användning av brom
c) Reaktion med halogenhydrider (syrahalogenider)
Reaktion av cykloalkanen med den halogeninnehållande oorganiska hydratmolekylen (HCl. HBr, HI). Eftersom en syra används som en reaktant, används inte en katalysator. I denna reaktion kommer cykloalkanen att ge upphov till a organisk halogenid med endast en halogenatom i kedjan. Efter att cykeln har brutits har vi tillägg av en väteatom på ett av kolen i sigmabindningen som bröts och en halogen på det andra kolet. Följer Markovnikovs regel (H på det mest hydrerade kolet och halogen på det minst hydrerade kolet).
Obs: Det förekommer endast med cyklopropan och cyklobutan.
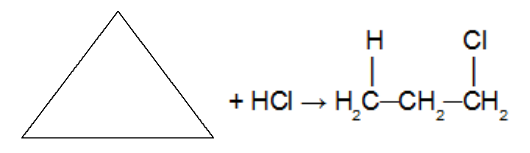
Tillsatsreaktion i cyklopropan med användning av saltsyra
Obs: Det förekommer endast med cyklopropan och cyklobutan.
d) Hydrering
Reaktion av cykloalkan med en vattenmolekyl i närvaro av svavelsyra och uppvärmning. I denna reaktion kommer cykloalkanen att ge upphov till a mono alkohol (alkohol med endast en OH-grupp i kedjan). Efter att cykeln har brutits har vi tillägg av en väteatom på ett av kolen i sigmabindningen som bröts och en hydroxyl (OH) på det andra kolet. Följer Markovnikovs regel (H på det mest hydrerade kolet och hydroxyl på det minst hydrerade kolet).
Obs: Det förekommer endast med cyklopropan och cyklobutan.

Tillsatsreaktion i cyklopropan med användning av saltsyra
Av mig Diogo Lopes Dias
Källa: Brasilien skola - https://brasilescola.uol.com.br/quimica/adicoes-ciclanos.htm

