Denna blandning av gaser ger upphov till homogena blandningar eller gaslösningar. Till exempel sprids gaserna som kommer ut ur fabrikens skorstenar, eller bilavgaser, genom luften atmosfäriska och, med tidens gång, kunde vi inte särskilja dem längre, eftersom det skedde en diffusion av dessa gaser genom luft.

Gaserna som släpps ut från skorstenarna sprids och "försvinner" i den atmosfäriska luften, eftersom luftvolymen är mycket större än rökens.
| DE diffusion av en gas är en spontan rörelse av en gas genom en annan, det vill säga dess spridning i ett annat gasformigt medium. |
| DE utgjutning av gaser är en speciell typ av diffusion, där det finns läckage av gaser genom små hål (eller porösa väggar, som är en uppsättning små hål). |
Till exempel är ballonger som säljs till barn fyllda med heliumgas. Med tiden kommer denna gas att passera genom ballongens gummiporer, det vill säga dess utgjutning. Detta visas av det faktum att ballongen töms efter några timmar.
Den skotske kemisten Thomas Graham studerade 1829 detta beteende hos gaser. Han drog slutsatsen att hastigheten med vilken en gas diffunderar eller strömmar ut i en annan är relaterad till dess densitet. När hans experimentella data upprepades för alla gaser skapade han följande lag som bär hans namn:
Grahams lag: hastigheten för diffusion eller effusion av en gas är omvänt proportionell mot kvadratroten av dess densitet.
Matematiskt kan denna lag uttryckas med ekvationen:
v a 
Eller, relaterat till två olika gaser, vi har:
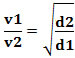
Den enhet som används i det här fallet är "volymen som avgår per tidsenhet"; därför generellt L/min (liter per minut).
Således diffunderar gaser med lägre densitet snabbare. Om den är i samma temperatur- och trycktillstånd kan man också göra ett samband mellan detta och massan gasmolar: ju större densitet gasen har, desto större molmassa och desto lägre hastighet diffusion; och vice versa. Vi har alltså:
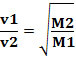
Av Jennifer Fogaça
Examen i kemi
Brasilien skollag
Källa: Brasilien skola - https://brasilescola.uol.com.br/quimica/difusao-efusao-dos-gases.htm