Ett polär förening (eller substans) är en som har två regioner med olika elektrondensiteter. En av dessa regioner har en positiv karaktär (vitt område), och en annan har en negativ karaktär (gult område), som vi kan se i följande representation:

Representation av regioner med olika laddning i en polär förening
Vet om en viss kompositen är polär innebär att veta vilken typ av intermolekylär kraft som gynnar interaktionen mellan dess molekyler eller med molekyler av andra ämnen, samt göra antaganden om deras löslighet och smältpunkter och kokande.
Till exempel: med avseende på löslighet har polära föreningar god förmåga att lösas upp till polära föreningar. När det gäller intermolekylära krafter, beroende på fallet, kan polära föreningar interagera med krafter permanenta dipol- eller vätebindningar (styrka som också resulterar i högre smältpunkter och kokande).
Här är två praktiska sätt att avgöra om en förening är polär eller inte.
Bestämning av polaritet genom antal moln och antal ligander
Vi kan avgöra om a
kompositen är polär genom förhållandet mellan antalet lika stora atomer fästa vid den centrala atomen och antalet elektronmoln i den centrala atomen.Notera: Ett elektronmoln är vilken kemisk bindning som helst mellan två atomer, eller ett par elektroner från valensskalet på en atom som inte deltar i en bindning.
Om antalet moln som finns i den centrala atomen skiljer sig från antalet lika ligander i den centrala atomen, har vi en polär förening. För att bättre förstå, följ exemplen nedan:
1:a exemplet: Blåvätesyramolekyl
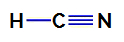
Strukturformel för blåvätesyra
I cyanvätesyra är den centrala atomen kol, som har fyra elektroner i sig valensskikt för att tillhöra IVA-familjen i det periodiska systemet. Hur kol gör en enkelbindning (som delar två elektroner, med en elektron från varje atom involverade) med väte och en trippelbindning med kväve, så det finns inga icke-bindande elektroner i atomen central.
Således, i blåvätesyra, finns det närvaro av två elektroniska moln (en enkelbindning och en trippelbindning) och en ligand lika med den andra. Därför är det en polär förening.
2:a exemplet: Ammoniakmolekyl (NH3)
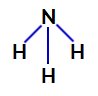
Ammoniak strukturformel
I ammoniak är den centrala atomen kväve, som har fem elektroner i sitt valensskal eftersom det tillhör VA-familjen i det periodiska systemet. Eftersom kväve gör en enkelbindning (delning av två elektroner, med en elektron av varje inblandad atom) med varje väteatom deltar två av dess fem elektroner inte i bindningar.
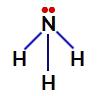
Icke-kvävebindande elektroner i ammoniak
I ammoniak finns det alltså fyra elektronmoln (tre enkelbindningar och det icke-bindande elektronparet) och tre lika stora ligander (de tre vätena). Så det är en polär förening.
Bestämning av polaritet genom dipolmomentvektorn för en förening
Vi kan avgöra om a kompositen är polär genom analysen av resulterande dipolmomentvektor i sin strukturformel, med hänsyn till dess molekylär geometri och skillnaden på elektronnegativitet mellan de inblandade atomerna.
Notera: Fallande ordning för elektronegativitet för elementen: F > O > N > Cl > Br > I > S > C > P > H.
När summan av vektorerna som finns i molekylen skiljer sig från noll kommer föreningen att vara polär. För att bättre förstå, följ följande exempel:
1:a exemplet: triklormetanmolekyl
Triklormetan är en förening som presenterar tetraedrisk geometri, som vi kan se i dess strukturformel nedan:

Strukturformel för triklormetan
För att ta reda på om det är en polär förening eller inte måste vi initialt placera dipolmomentvektorerna (pilar som indikerar vilken atom som är mer stabil än den andra) i den strukturella, som i följande exempel:
Notera: Klor är ett mer elektronegativt grundämne än kol. I sin tur är kol ett mer elektronegativt grundämne än väte.
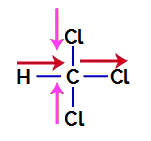
Dipolmomentvektorer i triklormetan
Vektorer i rosa kan representeras av +x och -x, eftersom de har samma riktning (vertikal) och motsatta riktningar (upp och ner). Vektorer i rött representeras av +x, eftersom de har samma riktning och samma riktning. Således representeras den resulterande dipolmomentvektorn (summan av vektorerna) av:
μr = (+x) + (-x) + (+x) + (+x)
μr = +X – x + x + x
μr = 2x
Eftersom den resulterande dipolmomentvektorn inte är noll, har vi a polär förening.
2:a exemplet: vattenmolekyl
Vatten är en förening som presenterar vinkelgeometri, som vi kan se i dess strukturformel nedan:
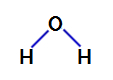
Strukturformel för vatten
För att ta reda på om det är en polär förening eller inte måste vi initialt placera dipolmomentvektorerna (pilar som indikerar vilken atom som är mer stabil än den andra) i strukturen, som visas nedan:
Notera: Syre är ett mer elektronegativt grundämne än väte.
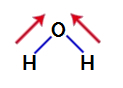
dipolmomentvektorer i vatten
Eftersom de två vektorerna i vattenstrukturen är diagonalt över, måste vi använda parallellogramregeln. I den här regeln, när vi länkar baserna för vektorerna, har vi skapandet av en resulterande vektor (som ersätter de två som användes tidigare), som i följande modell:
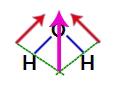
Resulterande vektor i strukturformeln för vatten
Eftersom vattenmolekylen har en enda vektor är därför den resulterande dipolmomentvektorn icke-noll, det vill säga vi har en polär förening.
Av mig Diogo Lopes Dias
Källa: Brasilien skola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-um-composto-polar.htm
