Mekanismen är en simulering av hur reaktionen bearbetas, den beskriver de steg som reaktanterna går igenom för att nå slutprodukten.
Mekanismer föreslogs baserat på experiment, eftersom det inte är möjligt att visualisera steg för steg av en reaktion, och är mycket användbara i Organisk kemi, eftersom organiska föreningar reagerar med varandra på olika sätt: bryta bindningar, bilda föreningar förmedlarna.
Det finns faktorer som stör reaktionens slutprodukt, som till exempel lösningsmedlets natur, bindningars polaritet, utbyte av elektroner etc. Därför är en viss mekanism inte alltid det enda sättet för bildningen av produkten, de kan ske på olika sätt, exempelvis joniskt eller via fria radikaler.
1. jonmekanism: process som startar genom heterolytisk brytning av en kovalent bindning och bildning av joner (karbokatjon och karbanjon).
Spåra alkenhalogeneringsmekanismen.
Vi kan dela upp mekanismen i steg:
1:a etappen: Heterolytisk störning av den kovalenta bindningen (Cl - Cl): bildning av karbokatjonen och anjonen (Cl-).
2:a etappen: Kloridanjon (Cl-) angrepp på karbokation.
3:e etappen: Bildning av produkt 1,2 - diklorpropan.
Som kan ses sker halogeneringen av alkener genom en jonmekanism.
Notera: Som namnet antyder görs halogenering genom att tillsätta en halogen (klor) till molekylen.
2. Mekanism via fria radikaler: det homolytiska brottet av en kovalent bindning bildar fria radikaler (mycket instabila och reaktiva), låt oss titta på ett exempel:
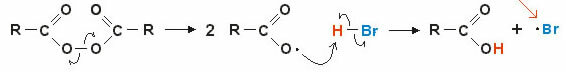
Reaktionen börjar med att peroxidbindningen bryts och fria radikaler bildas. I det mellanliggande steget sker radikalangreppet på det polariserade vätet av (H — Br) och därav följande bildning av den nya fria radikalen • br (mycket instabil och reaktiv).
Av Líria Alves
Examen i kemi
Brasilien skollag
Se mer!
Radikaler i organisk kemi
Organisk kemi - Kemi - Brasilien skola
Källa: Brasilien skola - https://brasilescola.uol.com.br/quimica/mecanismos-reacoes-organicas.htm

