Ämnesmolekylerna är inte alla raka, som om de befann sig i ett enda plan. När allt kommer omkring är de utspridda i rymden och deras atomer antar olika arrangemang eller arrangemang. Det finns alltså olika geometriska former för molekylerna för varje typ av ämne.
Ett av de enklaste sätten att bestämma en molekyls geometri är baserat på teorin om repulsion av valensskalelektronpar (RPECV). Enligt denna teori fungerar centralatomens elektronpar som elektroniska moln som stöter bort varandra. På så sätt är de orienterade så långt bort från varandra som möjligt. Molekylär geometri kommer att bero på antalet elektroniska par runt den centrala atomen.
Detta elektroniska moln kan vara sammansatt av elektroner som deltar i bindningar (enkel, dubbel eller trippel) och även som inte deltar. Så vi har:
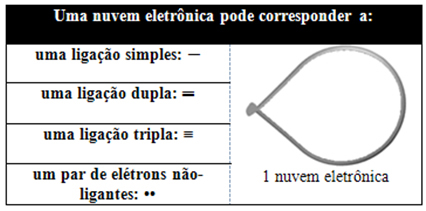
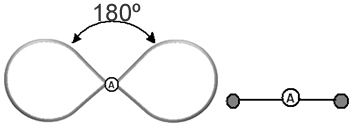
Det hjälper att tänka på detta moln som en tjud ballong eller ballonger, med den centrala atomen i mitten av dem. Till exempel, i en molekyl som bara har två elektronmoln runt den centrala atomen, desto större möjliga avstånd mellan dem är en vinkel på 180º och följaktligen kommer molekylens geometri att vara linjär.
Därför kan vi dra en slutsats om hur molekylgeometrin för de flesta molekyler kommer att se ut om vi tar hänsyn till antal atomer i molekylerna och de bindningar som centralatomen gör, kontrollera om den har par av elektroner.
Se exemplen nedan:
- Molekyler med 2 atomer: kommer alltid att vara det linjär
Till exempel:
H ─ H, H ─ Cl, F ─ F, O ═ O, C ≡ O.
- 3-atoms molekyl: kantig eller triangulär
om den centrala atomen besitter ett par icke-bindande elektroner geometrin kommer att vara vinkel-, som i fallet med SO-molekylen2:
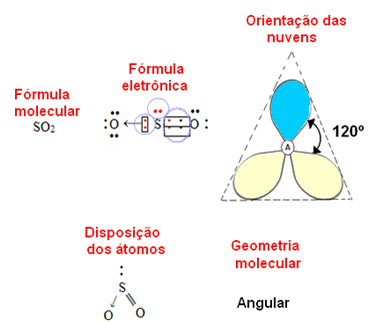
Anse att det blå elektronmolnet representerar elektronpar som inte deltar i bindningarna, och det gula är par av elektroner som deltar i bindningarna.
- 4-atoms molekyl: plan trigonal (eller triangulär) eller pyramidform (eller trigonal pyramid)
Om den centrala atomen inte har ett oparat (icke-bindande) elektronpar är molekylgeometrin platt trigonal (eller triangulär). Titta på BF-exemplet3:

Om atomen har icke-bindande elektronpar, kommer molekylens geometri att vara pyramidformad (eller trigonal pyramid), som i fallet med ammoniak:

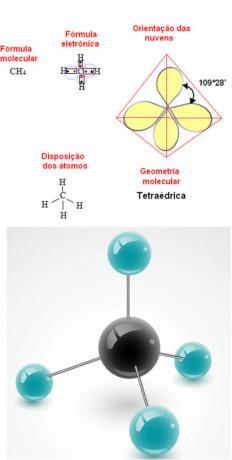
- 5-atoms molekyl: tetraedrisk
Exempel på metangeometri:
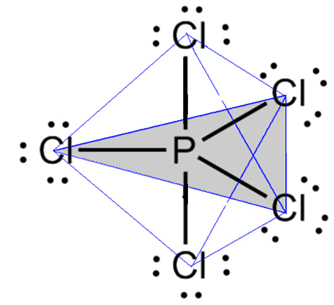
- Molekyl med 6 atomer: trigonal bipyramid eller triangulär pyramid.
Ett exempel är fosforpentaklorid (PCl5), som har vissa kopplingar mellan fosfor och klor i en vinkel på 90º och andra på 120º, och bildar en bipyramid med en triangulär bas:
- 7-atoms molekyl: oktaedrisk
Exempel: svavelhexafluorid (SF6), vars vinklar är 90º.

Av Jennifer Fogaça
Examen i kemi
Källa: Brasilien skola - https://brasilescola.uol.com.br/quimica/determinacao-geometria-das-moleculas.htm
