Kp är förkortningen som används för att bestämma konstant för en jämvikt när det gäller partiella tryck. Denna konstant arbetar till exempel med värdena för de gasformiga deltagarna i en jämvikt i atm-enheten.

Ekvation som representerar en kemisk reaktion med gasformiga komponenter
I denna ekvation är alla deltagare gasformiga, så när en deltagande gas har en partialtryck i blandningen, representeras den av förkortningen pX.
När man ställer upp den kemiska jämviktsekvationen (i termer av koncentration), måste produkterna placeras i täljaren och reaktanterna placeras i nämnaren:
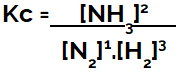
Kc uttryck av ammoniakbildningsjämvikt
uttrycket för jämviktskonstant uttryckt i tryck (Kp) följer mönstret av Kc, det vill säga partialtrycken för reagenserna är placerade i nämnaren och partialtrycken för produkterna i täljaren:
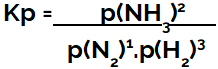
Kp uttryck av ammoniakbildningsjämvikt
Observation: Om reaktionsekvationen för kemisk balans inte presentera någon gasformig deltagare, kommer den inte att presenteras automatiskt Kp.
Exempel: (PUC-MG)
För reaktionen: 2 CO(g) + O2(g)? 2 CO2(g), partialtrycken för CO(g) det är2(g) vid jämvikt är de 0,2 atm respektive 0,4 atm. Det totala systemtrycket är 1,4 atm. Värdet av Kp för reaktionen är:a) 56,2
b) 40,0
c) 35,6
d) 28,4
e) 25,6
Uppgifterna från övningen är:
Kolmonoxidpartialtryck (pCO) = 0,2 atm;
Partialtryck av kolmonoxid (pO2) = 0,4 atm;
Totaltryck =1,4 atm;
För att bestämma Kp för detta system måste vi utföra följande steg:
1:a steget: Bestäm partialtrycket för kolmonoxid (pCO2).
För detta, kom bara ihåg att det totala trycket (pt) är summan av alla partialtryck:
pt = pCO + pCO2 + pO2
1,4 = 0,2 + p (CO2) + 0,4
1,4 - 0,2 - 0,4 = pCO2
pCO2 = 0,8 atm
Steg 2: Bestäm Kp för övningen.
För detta, använd bara värdena i uttrycket av jämviktskonstanten Kp:
Kp = (pCO2)2
(pCO)2.(damm2)1
Kp = (0,8)2
(0,2)2.(0,4)1
Kp = 0,64
0,04.0,4
Kp = 0,64
0,016
Kp = 40 atm-1
Av mig Diogo Lopes Dias
Källa: Brasilien skola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-kp.htm

