PH motsvarar den lösningens vätgaspotential. Det bestäms av koncentrationen av vätejoner (H+) och tjänar till att mäta surhetsgraden, neutraliteten eller alkaliniteten hos en given lösning.
Förutom pH finns det också en annan mängd som bestämmer surhetsgraden och basiteten hos ett vattenhaltigt system: pOH (hydroxyljonisk potential). Denna skala har samma funktion som pH, även om den används mindre.
pH-skala
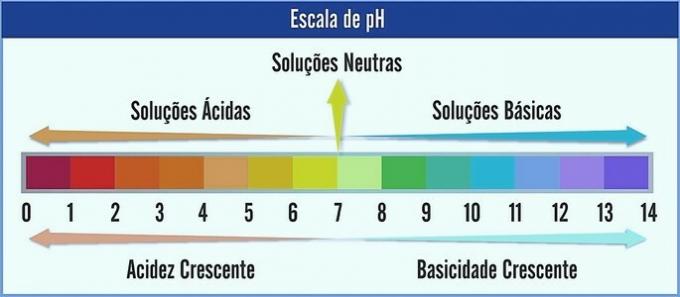
PH representeras på en skala från 0 till 14. Den mäter surhet och basitet hos en lösning.
Därför representerar pH 7 en neutral lösning (t.ex. rent vatten). De före den anses vara sura lösningar (surt pH) och de efter 7 är de grundläggande lösningarna (alkaliskt pH).
Med denna iakttagelse ökar syrakaraktären från höger till vänster. Grundkaraktären, från vänster till höger. Observera att ju lägre pH-värde desto surare blir lösningen.
Läs mer på:
- Buffert-lösning
- Titrering
- Neutraliseringsreaktion
Exempel
Syralösningar
| Lösning | pH |
|---|---|
| Magsyra | 2,0 |
| Citron juice | 2,2 |
| Vinäger | 3,0 |
| Kaffe | 5,0 |
| Komjölk | 6,4 |
Grundläggande lösningar
| Lösning | pH |
|---|---|
| mänskligt blod | 7,35 |
| Havsvatten | 7,4 |
| Natriumbikarbonat | 8,4 |
| Mjölk av magnesia | 10,5 |
| Bleka | 12,5 |
Hur beräknar man pH?
1909 föreslog den danska kemisten Soren Sörensen (1868-1939) att surhetsgraden i lösningar, mätt i koncentrationer av H-joner+, hade dess värden omvandlats med hjälp av logaritmer för att underlätta förståelsen.
Vid en temperatur av 25 ° C är den joniska produkten av vatten lika med 10–14 mol2/ L.2.
När vi använder kologaritmen i uttrycket måste vi:
Genom detta uttryck kan vi få motsvarande värde från en skala till en annan genom subtraktion.
Hur mäter man pH?
Kontroll av pH är viktigt inte bara för vetenskapliga ändamål utan också i vardagen.
Poolens pH måste kontrolleras, liksom akvariets pH och till och med markens pH för att möjliggöra vissa typer av grödor.
Nedan följer de viktigaste sätten att mäta pH.
syrabasindikator
Så kallade syrabasindikatorer används för att mäta pH i en lösning. De är ämnen som ändrar färg som indikerar lösningens karaktär. De mest använda indikatorerna är: lakmus och fenolftalein.

Stegräknare
Förutom indikatorer kan pH i en lösning mätas med hjälp av ett instrument som kallas en peagometer. Denna elektroniska enhet mäter lösningens elektriska konduktivitet och omvandlar den till skalan för pH-värden.

Entréexamensövningar med feedback
1. (Enem / 2014) En forskare inser att etiketten på ett av glasen där han håller ett koncentrat av matsmältningsenzymer är oläslig. Han vet inte vilket enzym glaset innehåller, men misstänker att det är ett gastrisk proteas, som fungerar i magen genom att smälta protein.
Att veta att matsmältningen i magen är sur och tarmen är basisk, han monterar fem provrör med mat olika, tillsätt enzymkoncentratet till lösningar med ett bestämt pH och vänta för att se om enzymet verkar i något deras.
Provröret där enzymet måste verka för att indikera att forskarens hypotes är korrekt är den som innehåller:
a) potatikub i lösning med pH = 9
b) köttbit i lösning med pH = 5
c) kokt äggvita i lösning med pH = 9
d) del nudlar i lösning med pH = 5
e) smörboll i lösning med pH = 9
Rätt alternativ: b) köttbit i lösning med pH = 5.
Proteas är ett enzym som smälter proteiner och eftersom det är gastrisk verkar det i magen, vars pH är surt.
När vi analyserar alternativen måste vi:
a) FEL. Potatis innehåller mycket kolhydrater och koncentratets pH är grundläggande.
b) KORREKT. Kött innehåller proteiner och enzymer kan verka på det, och koncentratet pH är surt, som magen.
c) FEL. Koncentrat pH är grundläggande.
d) FEL. Pasta är rik på kolhydrater.
e) FEL. Koncentrat pH är grundläggande.
2. (Udesc / 2009) "Syrregn" är en term som hänvisar till nederbörd från atmosfären av regn med större mängder salpetersyra och svavelsyra än normalt.
Föregångare till surt regn kommer både från naturliga källor, såsom vulkaner och ruttnande vegetation, och från processer industriella utsläpp, främst svaveldioxid och kväveoxider från brinnande bränslen fossiler.
PH-värdet för regnvatten som anses normalt är 5,5 (på grund av närvaron av kolsyra från solubilisering av koldioxid). En kemist som övervakade en starkt industrialiserad region noterade att pH i regnvatten var 4,5.
Med tanke på att surhet är relaterad till koncentrationen av H3O+, är det korrekt att säga att vatten med pH 4,5 var:
a) dubbelt så grundläggande som normalt.
b) dubbelt så surt som normalt.
c) tio gånger mer grundläggande än normalt.
d) tio gånger surare än normalt.
e) hundra gånger surare än normalt.
Rätt alternativ: d) tio gånger surare än normalt.
Enligt uttrycken pH = - log [H+] och [H+] = 10-pH, Vi måste:
pH = 5,5
[H+] = 10-5,5
pH = 4,5
[H+] = 10-4,5
Skillnaden mellan värdena är: 10- 5,5 - ( - 4,5) = 10 -1
Eftersom pH-skalan är en logaritmisk skala, är det en tio gånger mer sur lösning att ändra en enhet.
3. (UFMG / 2009) Tänk på en viss mängd vatten och citronsaft, blandat, i ett glas. Granska dessa tre påståenden angående detta system:
I. Systemet är surt.
II. Systemets pH är större än 7.
III. I systemet koncentrationen av H-joner+ är större än OH–.
Baserat på denna analys är det korrekt att ange att:
a) endast uttalanden I och II är korrekta.
b) endast uttalanden I och III är korrekta.
c) endast påståenden II och III är korrekta.
d) alla tre påståenden är korrekta.
Rätt alternativ: b) endast uttalanden I och III är korrekta.
I. KORREKT Citron innehåller citronsyra, som i lösning frigör H-joner+ och så är systemet surt.
II. FEL. PH är mindre än 7, vilket kännetecknar ett surt system: ju närmare 0 lösningens pH, desto surare är det.
III. KORREKT Det sura pH-värdet är ett resultat av den höga koncentrationen av H-joner+ i lösning, eftersom pH = - log [H+].
För fler frågor, med en kommenterad upplösning, se till att kolla:Övningar på pH och pOH.


