Sulfater är jonföreningar som innehåller anjonen SO42-, som kallas sulfatanjonen.
Svavel är ett element i 16- eller VI-A-familjen, vilket innebär att den har 6 elektroner i sitt valensskal. Enligt oktettregeln skulle det behöva ta emot ytterligare 2 elektroner för att ha 8 elektroner i det sista elektronskalet och därmed vara stabila. Men svavel genomgår oktettexpansion, eftersom det är ett element som ligger i den tredje perioden av tabellen Periodisk, är relativt stor, vilket gör att den kan rymma mer än åtta elektroner till sin runt omkring.
Såsom kan ses nedan expanderar svavelens valensnivå till totalt 12 elektroner. Men två syreatomer är fortfarande inte stabila, var och en med sju elektroner i valensskalet och behöver därför ta emot ytterligare en elektron för att stabilisera sig. Av denna anledning är laddningen för var och en av dessa två atomer -1, vilket resulterar i en total laddning för anjonen -2:
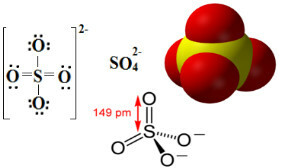
Sulfatanjonen kan komma från svavelsyra (H2ENDAST4 (aq)) som visas nedan:
Svavelsyra reagerar med en viss bas i en neutraliseringsreaktion och bildar ett oorganiskt salt, vilket är vårt sulfat, och även vatten:
Generisk reaktion: Svavelsyra + bas → Salt (sulfat) + vatten
H2ENDAST4 + 2 Çåh →Ç2ENDAST4+ 2 H2O
Se ett exempel nedan där kaliumsulfat bildas:
H2ENDAST4 + 2 KOH →K2ENDAST4+ 2 H2O
Observera att nomenklaturen för ett sulfat görs helt enkelt genom regeln: sulfat + namnet på det element som är fäst vid det. Dessutom görs formlerna för sulfater genom att byta laddningen för varje jon mot elementindexet, med indexet "1" som inte behöver skrivas:
Exempel:
På+1 ENDAST42- → På2ENDAST4→ natriumsulfat
mg+2 ENDAST42- → MgSO44→ magnesiumsulfat
Här+2 ENDAST42- → Fall4→ kalciumsulfat
Ba+2 ENDAST42- → BASO4→ bariumsulfat
Al+3 ENDAST42- → Al2(ENDAST4)3→ aluminiumsulfat
Salter som innehåller sulfatjonen är vanligtvis lösliga i vatten, med undantagen fyra: kalciumsulfat (CaSO4strontiumsulfat (SrSO4bariumsulfat (BaSO4) och blysulfat (PbSO4). Detta beror på att det finns en hög bindningsenergi mellan dessa katjoner (Ca2+, herr2+Ba2+ och Pb2+) och sulfat, eftersom de alla har en +2 laddning och sulfatanjonen har en -2 laddning. Således blir det svårare att bryta den anslutningen.
Sulfater finns i form av kristallina gitter på grund av den attraktion som motsatta laddningar utövar på varandra, vilket visas nedan när det gäller kopparsulfat (CuSO4):

Sulfater finns i naturen främst i form av mineraler. Se några exempel:
barite → bariumsulfat;
Gips → kalciumsulfat;
Celestite → strontiumsulfat;
anglesiOK → bly sulfat;
Glauberit → dubbel kalcium och natriumsulfat: CaNa2(ENDAST4)2;
Kaliumalun (kalinit) → hydrerat dubbelkaliumaluminiumsulfat: KAl (SO42.11H2O
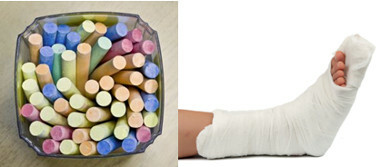
Bland de viktigaste sulfaterna i vardagen har vi kalciumsulfat, som i vattenfri form (utan vatten) används vid tillverkning av skolkrita. När det är i dihydratform, (CaSO4 .2h2O), det är känt som gips och är rikligare. Vid uppvärmning bildar det kalciumsulfathemihydrat (CaSO4. ½H2O), som är gips, används i ortopedi, tandformar, civila konstruktioner och färger.
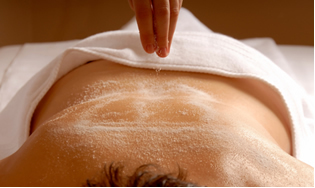
Ett annat viktigt salt är smagnesiumsulfat (MgSO44), känd som sbitter al eller Epsom salt, som har en laxerande verkan och används för massage och avkopplande bad.
Av Jennifer Fogaça
Examen i kemi
