Kolväten är föreningar som endast bildas av kol och väte, med en allmän formel: CxHy.
Det är en omfattande mängd ämnen, av vilka de mest kända är beståndsdelar i olja och naturgas.
Ryggraden i ett kolväte består av kol och i sin tur binder väteatomerna genom en kovalent bindning.
De används i stor utsträckning inom den kemiska industrin, eftersom de är väsentliga vid produktion av petroleumderivat: bland annat bränslen, polymerer, paraffiner.
Egenskaper hos kolväten
| molekylär interaktion | De är praktiskt taget opolära föreningar och deras molekyler är förenade av en inducerad dipol. |
|---|---|
| Smältpunkt och kokpunkt | De är låga jämfört med polära föreningar. |
| aggregeringstillstånd |
|
| Densitet | De har en lägre densitet än vatten. |
| Löslighet | De är olösliga i vatten och lösliga i icke-polära ämnen. |
| Reaktivitet |
|
Klassificering av kolväten
När det gäller formen av huvudkolkedjan klassificeras kolväten i:
alifatiska kolväten
Bildas av öppna eller acykliska kolkedjor, som har terminala kol.
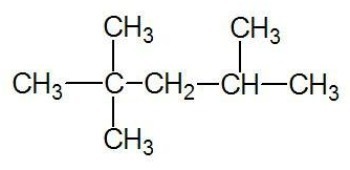
- alkaner
- alkener
- Alkynes
- Alkadienes
Exempel:
Se också: kolkedjor
Cykliska kolväten
Bildad av slutna eller cykliska kolkedjor som inte har terminala kol.
- Cyklar
- Cyklar
- cyklister
- Aromater
Exempel:
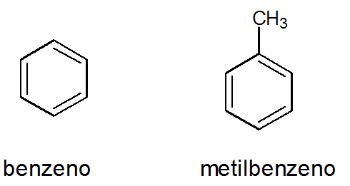
Se också: bensen
När det gäller bindningar av kolkedjor, antingen enkla, dubbla eller tredubbla:
Mättade kolväten
Föreningar bildas av enstaka bindningar mellan kol- och väteatomer.
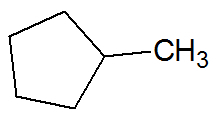
- alkaner
- Cyklar
Exempel:
omättade kolväten
De bildade föreningarna har dubbla eller trippelbindningar mellan kol- och väteatomer.
- alkener
- Alkynes
- Alkadienes
- Cyklar
- cyklister
- Aromater
Läs också om:
- Kemiska bindningar
- Organisk kemi
- Organiska funktioner
Nomenklatur
Nomenklaturen för kolväten definieras av följande termer:
| PREFIX | MELLANHAND | ÄNDELSE |
|---|---|---|
| Anger antalet kol som finns i kedjan. | Typ av länk i strängen. | Identifiering av den funktionella gruppen. |
| PREFIX | MELLANHAND | ÄNDELSE | ||
|---|---|---|---|---|
| 1C | TRÄFFADE | Endast en länk | ETT | O |
| 2C | ET | |||
| 3C | STÖTTA | en dubbelbindning | SV | |
| 4C | MEN | |||
| 5C | PENT | två dubbelbindningar | DIEN | |
| 6C | HEX | |||
| 7C | HEPT | en trippel länk | I |
|
| 8C | OKT | |||
| 9C | EJ | Två trippel länkar | DIIN | |
| 10C | DEC |
Exempel
Följ hur kolvätenamn bildas:
| Etan |
- Prefix: ET, vilket motsvarar 2 kol.
- Mellanhand: ETT, vilket motsvarar enstaka länkar.
- Ändelse: O, vilket motsvarar kolvätefunktionen.
Titta på de andra exemplen:
| Propan | |
| Ethene | |
| Etino | |
| propadien |
I vissa fall är det nödvändigt att ange positionen för dubbel- eller trippelbindningen. Numreringen måste börja från den närmaste änden av den länken.
| 1,3-butadien | |
| 1-butyne |
Läs mer på:
- Butan
- Metan
Typer av kolväten
Kolla in huvudtyperna av kolväten, deras egenskaper och de använda föreningarna:
alkaner
De är öppna kolväten med enstaka bindningar mellan kol- och väteatomer, vars allmänna formel är ÇNejH2n + 2.
Alkanesegenskaper
- De kallas också paraffiner eller paraffiner.
- De finns i naturen i naturgas och olja.
- Används som bränsle: matlagningsgas, bensin, dieselolja etc.
Exempel på alkaner

alkener
De är öppna kolväten och har en dubbelbindning vars allmänna formel är ÇNejH2n.
Alkenes egenskaper
- De kallas också olefiner, alkener eller etyleniska kolväten.
- De erhålls industriellt genom sprickbildning av alkaner som finns i olja.
- De används som råvara i industrin: plast, färgämnen, sprängämnen etc.
Exempel på alkener

Alkynes
De är öppna kolväten med närvaro av en dubbelbindning, vars allmänna formel är ÇNejH2n-2.
Alkynes egenskaper
- De är mer reaktiva än alkaner och alkener på grund av trippelbindningen.
- Alkyner med mer än 14 kolatomer är fasta.
- Den mest använda alkynen är acetylen, som vanligtvis används vid tillverkning av syntetiska gummi, textilfibrer och plast.
Exempel på alkyner

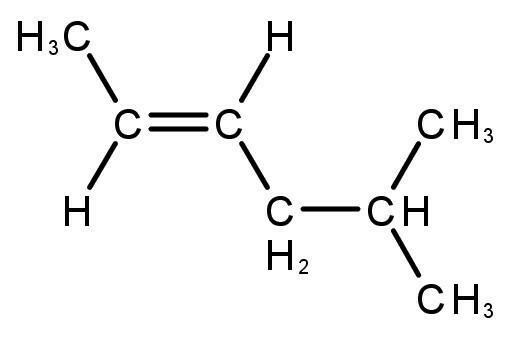
Alkadienes
De är öppna kolväten och närvaron av två dubbelbindningar, vars allmänna formel är ÇNejH2n-2
Egenskaper hos alkadiener
- Kallas också diener eller diolefiner
- De finns i naturen i terpener, som extraheras från eteriska fruktoljor.
- Den mest kända föreningen är isopren, som finns i naturgummi och eteriska oljor.
Exempel på alkadiner

Cyklar
De är slutna kolväten med enstaka bindningar mellan kol- och väteatomer, vars allmänna formel är ÇNejH2n.
Cyclan-egenskaper
- De kallas också cykloalkaner eller cykloparaffiner.
- De är instabila när de utsätts för högt tryck.
- Kedjor med mer än 6 kol är stabila, medan kedjor med mindre än 5 kol är reaktiva.
Exempel på cyklanter

Cyklar
De är slutna kolväten med närvaron av en dubbelbindning vars strukturformel är ÇNejH2n-2.
Kännetecken för cykler
- De kallas också cykloalkener.
- Föreningar med 3 till 5 kol är instabila.
- De finns vanligtvis i naturgas, olja och petroleum.
Exempel på cykler
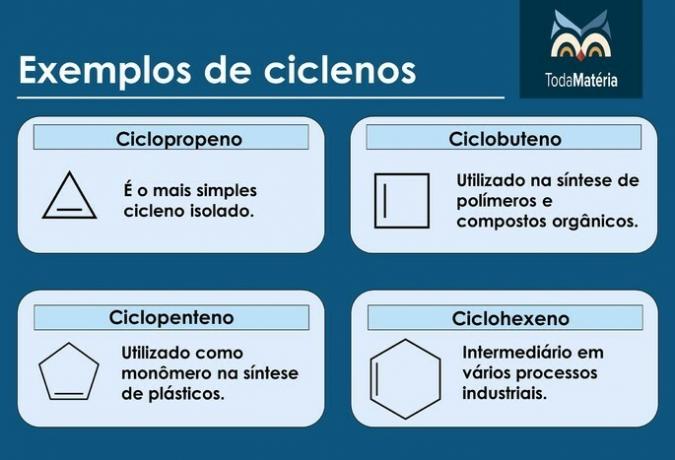
cyklister
De är slutna kolväten med närvaron av en trippelbindning, vars strukturformel är ÇNejH2n-4.
Cykelegenskaper
- De kallas också cykloalkyner eller cykloalkyner.
- De är cykliska och omättade kolväten.
- De är instabila på grund av trippelbindning och finns inte i naturen.
Exempel på cykliner

Aromater
De är slutna kolväten med alternerande enkel- och dubbelbindningar.
Kännetecken för aromater
- De kallas också arenor.
- De är omättade föreningar, eftersom de har 3 dubbelbindningar.
- De består av minst en aromatisk ring.
Exempel på aromater
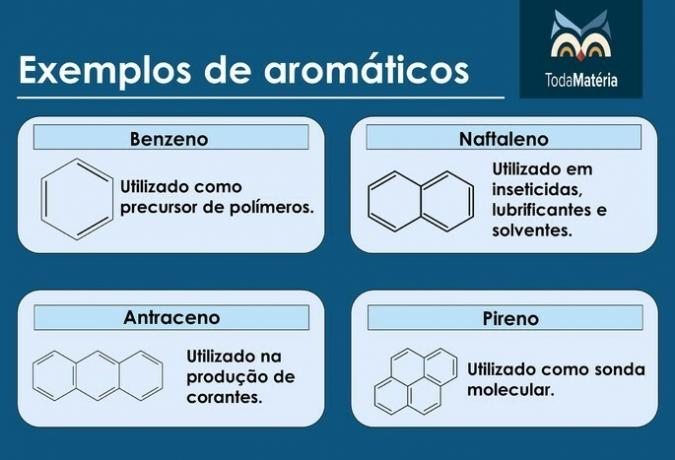
- Petroleum
- oljeraffinering
- Acetylen
Sammanfattning av kolväten
| Ockupation | Allmän formel |
Funktioner |
|---|---|---|
| alkan | Öppen kedja med enkla länkar. |
|
| alken | Öppen kedja med dubbelbindning. | |
| alkyn | Öppen kedja med trippelbindning. | |
| alkadien | Öppen kedja med två dubbelbindningar. | |
| Cyklar | Sluten kedja med enkla anslutningar. | |
| Cyklar | Sluten kedja med dubbelbindning. | |
| cyklister | Sluten kedja med trippel länk. | |
| Aromatisk | Variabel | Sluten kedja med alternerande enkel- och dubbelbindningar. |
Övningar på kolväten
1. (UEMA) LPG (Liquefied Petroleum Gas), även populärt kallat matlagningsgas, är ett bränsle icke-förnybart fossil som kan ta slut över natten om det inte används med planering och utan överskott. Den består bland annat av propan C3H8, butan C4H10 och små mängder propylen C3H6 och buten C4H8. Dessa organiska föreningar klassificeras som kolväten som har likheter och skillnader mellan dem. Baserat på typen av bindning mellan kol och klassificeringen av kolkedjan hos föreningarna ovan kan det konstateras att:
a) de omättade föreningarna är propan och butan.
b) de omättade föreningarna är propen och buten.
c) de omättade föreningarna är propen och butan.
d) föreningarna har homocykliska kedjor.
e) föreningarna har heterocykliska kedjor.
Alternativ b) de omättade föreningarna är propen och buten.
a) FEL. Dessa föreningar har inte omättningar, deras bindningar är enkla.
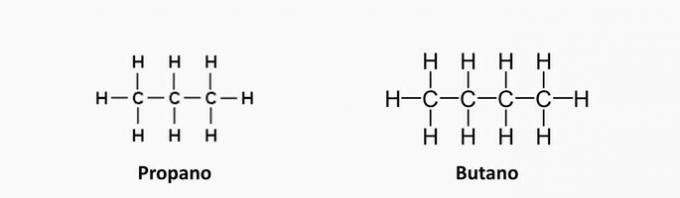
b) KORREKT. Uttrycket "en" indikerar närvaron av dubbelbindningar i föreningarna.

c) FEL. Butan har inga omättningar.

d) FEL. Dessa kedjor är stängda och kolatomerna är länkade med enkelbindningar.
e) FEL. Dessa kedjor har en heteroatom, såsom syre och kväve.

2. (Uel) En av kolvätena med formel C5H12 kan ha kolkedja:
a) mättad cyklisk.
b) heterogen acyklisk.
c) grenad cyklisk.
d) omättad öppen.
e) öppen grenad.
Alternativ e) öppen grenad.
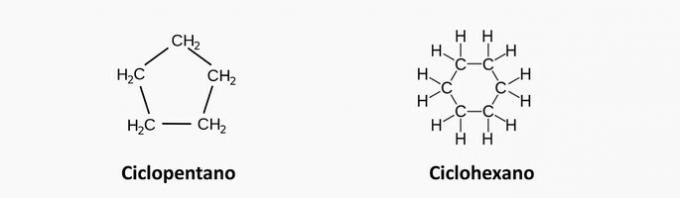
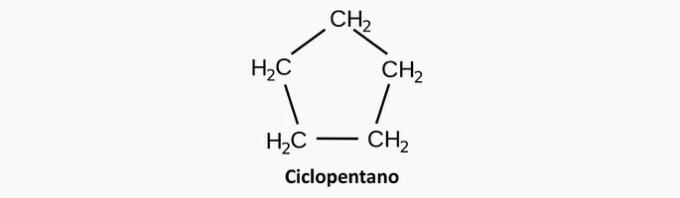
a) FEL. En mättad cyklisk förening motsvarar en cyklan, vars formel är CNejH2n.
Exempel:
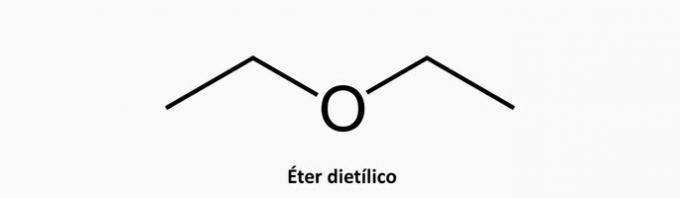
b) FEL. En heterogen acyklisk förening har närvaron av ett annat element förutom det interkalerade kolet i kedjan.
Exempel:
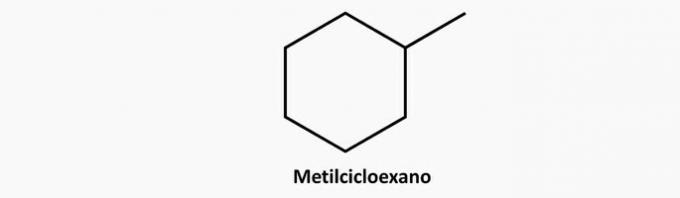
c) FEL. En grenad cyklisk förening har formel CNejH2n.
Exempel:
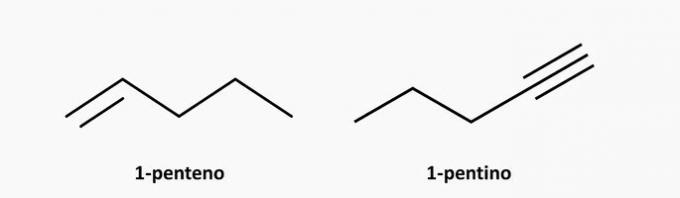
d) FEL. En omättad öppen kedjeförening kan vara en alken eller en alkyn, vars formel är respektive C.NejH2n och CNejH2n-2.
Exempel:
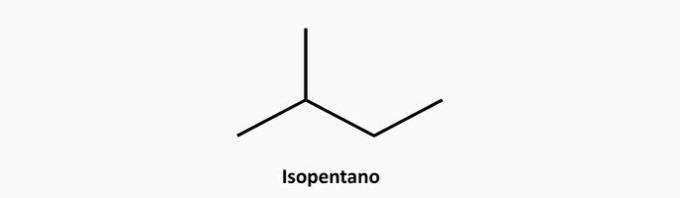
e) KORREKT. En grenad förening med öppen kedja är en alkan vars formel är CNejH2n + 2. En förening med 5 kolatomer och 12 väten kan vara isopentan.
Exempel:
3. (PUC) Alkyner är kolväten:
a) mättade alifatiker.
b) mättade alicykliska medel.
c) dubbelbundet omättade alifatiker.
d) trippelbindning omättade alicykliska medel.
e) trippelbindning omättade alifatiker.
Alternativ e) trippelbindning omättade alifatiker.
a) FEL. De öppenkedjiga och enkelbundna föreningarna är alkaner.
Exempel:

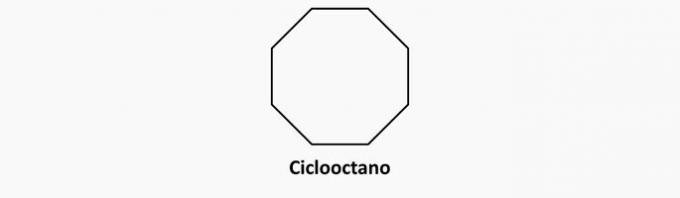
b) FEL. Cykliska föreningar med enkelbindningar är cyklaner.
Exempel:
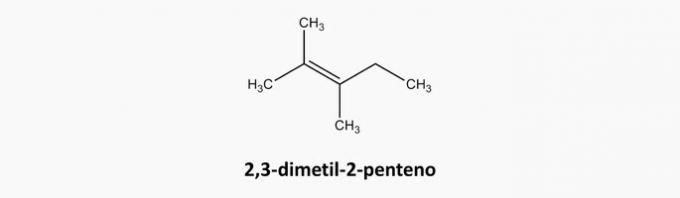
c) FEL. Öppen kedja och dubbelbundna föreningar är alkener.
Exempel:
d) FEL. Cykliska och trippelbundna föreningar är cykliner.
Exempel:
e) KORREKT. Alkyner är öppna kedjor och trippelbundna föreningar.

Vill du fortsätta testa dina kunskaper? Var noga med att kolla in dessa listor:
- Övningar på kolväten
- Övningar om organisk kemi
- Övningar om organiska funktioner