Smältpunkten och kokpunkten representerar temperaturen vid vilken ett ämne byter tillstånd vid ett givet tryck.
När det gäller smältpunkten ändras ämnet från fast tillstånd till flytande tillstånd. Kokpunkten hänför sig till övergången från flytande tillstånd till gasform.
Till exempel börjar is förvandlas till vatten i flytande form när dess temperatur är lika med 0 ° C. Därför är smältpunkten för vatten 0 ° C (under ett tryck av 1 atmosfär).
För att växla från vätska till ånga måste vattnet nå en temperatur på 100 ° C. Således är kokpunkten för vatten 100 ° C (under ett tryck av 1 atmosfär).

Fusionspunkt
När ett ämne i fast tillstånd tar emot värme, det finns en ökning av graden av agitation av dess molekyler. Följaktligen ökar dess temperatur.
När man når en viss temperatur (smältpunkt) är molekylernas omrörning sådan att de bryter de inre bindningarna mellan atomer och molekyler.
Vid denna tidpunkt börjar ämnet att ändra sitt tillstånd och kommer att gå i flytande tillstånd om det fortsätter att ta emot värme.
Under Fusion dess temperatur förblir konstant, eftersom den mottagna värmen endast används för att ändra tillståndet.

Värmen per massaenhet som krävs för att ändra fas kallas latent värme av fusion (Lf) och är en egenskap hos ämnet.
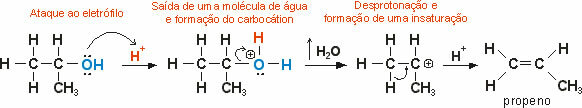
Smältpunkt och latent värmebord
I tabellen nedan anger vi smältpunktstemperaturen och latent värme för vissa ämnen till atmosfärstryck.
Kokpunkt
DE kokande det kännetecknas av den snabba passagen från en vätska till ett gasformigt tillstånd, med bildandet av ångor (bubblor) inuti vätskan.
Som vid fusion finns det en temperatur (kokpunkt) vid vilken ett givet ämne ändras från en vätska till ett gasformigt tillstånd.
För att detta ska kunna ske måste ämnet få värme. Under hela fasförändringen förblir temperaturen konstant.
den latenta värmen av förångning (Lv) är mängden värme per massaenhet som krävs för att ett ämne ska ändra fas.
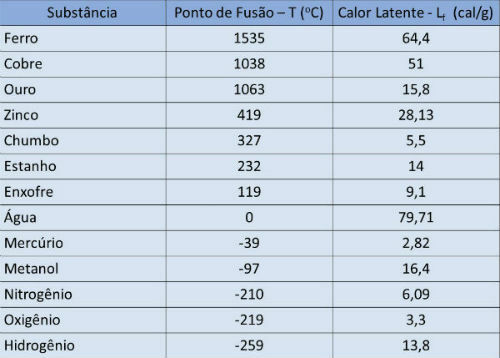
Kokpunkt och latent värmebord
I tabellen nedan anger vi kokpunktstemperaturen och den latenta förångningsvärmen för vissa ämnen vid atmosfärstryck.
Tryckstörningar
Smältpunktens och kokpunktens temperatur beror på trycket som utövas på ämnet.
I allmänhet ökar ämnen i volym när de genomgår fusion. Detta faktum betyder att ju högre tryck desto högre temperatur för ämnet att ändra fas.
Undantaget förekommer med vissa ämnen, inklusive vatten, som minskar volymen när den smälts. I detta fall kommer högre tryck att sänka smältpunkten.

En minskning av trycket gör att kokpunkten för ett givet ämne blir lägre, vilket innebär att ämnet kokar vid en lägre temperatur.
På platser över havsytan kokar vatten till exempel vid temperaturer under 100 ° C. Som ett resultat tar det mycket längre tid att laga mat på dessa ställen än på platser på havsnivå.
Läs också:
- Fysiska tillståndsförändringar
- Termometriska skalor
- Termometriska skalor - övningar
- Fysiska tillstånd av vatten
- Fasdiagram
- Stelning
- Kondensation
- Kolligativa egenskaper
- Periodiska egenskaper
- avdunstning
- Övningar på det periodiska systemet