Lösningsmedel och lösningsmedel är de två komponenterna i en homogen blandning som kallas en kemisk lösning.
- Lös: är ämnet som är dispergerat i lösningsmedlet. Det motsvarar det ämne som kommer att lösas och presenterar sig i allmänhet i en mindre mängd i lösningen.
- Lösningsmedel: är det ämne i vilket det lösta ämnet löses upp för att bilda en ny produkt. Det presenterar sig i större kvantitet i lösningen.
Upplösning mellan det lösta ämnet (dispergerat) och lösningsmedlet (dispergeringsmedlet) sker genom interaktioner mellan deras molekyler.
Skillnaden mellan dessa två komponenter i en lösning är att det lösta ämnet är det ämne som kommer att lösas upp och lösningsmedlet är det ämne som kommer att påverka upplösningen.
Det mest kända lösningsmedlet är vatten, anses vara universellt lösningsmedel. Det beror på att den har förmågan att lösa upp en stor mängd ämnen.
Exempel på lösningsmedel och lösningsmedel
Se några exempel på kemiska lösningar och upptäck lösningar och lösningsmedel för var och en av dem:
Vatten och salt
- Lösning: Bordsalt - Natriumklorid (NaCl)
- Lösningsmedel: Vatten
Eftersom det är en jonförening dissocieras natriumkloriden i lösningen och bildar joner som i sin tur solveras av molekyler av Vatten.
Den positiva polen av vatten (H+interagerar med anjonen av salt (Cl-) och den negativa polen av vatten (O2-interagerar med katjonen (Na+).
Detta är en typ av elektrolytisk lösning, eftersom den joniska arten i lösningen kan leda en elektrisk ström.
vatten och socker
- Lösning: Socker - Sackaros (C12H22O11)
- Lösningsmedel: Vatten

Socker är en kovalent förening och när den löses i vatten molekyler de sprids men ändrar inte sin identitet.
Denna vattenhaltiga lösning klassificeras som icke-elektrolytisk, eftersom det lösta ämnet som är dispergerat i lösningen är neutralt och därför inte reagerar med vatten.
Vinäger
- Lösningsmedel: ättiksyra (CH3COOH)
- Lösningsmedel: Vatten

Vinäger är en lösning som innehåller minst 4% ättiksyra, a karboxylsyra som är polar, samverkar med vatten, även polärt, genom vätebindningar.
En viktig regel för löslighet är att liknande löser upp. Polära föreningar löses i polära lösningsmedel, medan icke-polära ämnen löses i icke-polära lösningsmedel.
Andra lösningar
Förutom flytande lösningar finns det också gasformiga och fasta lösningar.
Luften vi andas in är ett exempel på en gasformig lösning, vars gaser i större kvantitet är kväve (78%) och syre (21%).
På metalllegeringar de är solida lösningar. Till exempel är mässing (zink och koppar) en blandning som används för att tillverka musikinstrument.
Vill du få mer kunskap? Så läs dessa andra texter:
- Kemiska lösningar
- intermolekylära krafter
- Homogena och heterogena blandningar
Vad är löslighetskoefficienten?
Löslighetskoefficienten är gränsen för tillsatt lösning till lösningsmedlet vid en given temperatur för att bilda en mättad lösning.
O löslighetskoefficient varierar beroende på förhållanden och kan öka eller minska med temperaturförändringar och löst ämne i fråga.
Det finns en gräns för vilken lösningsmedlet kan lösas.
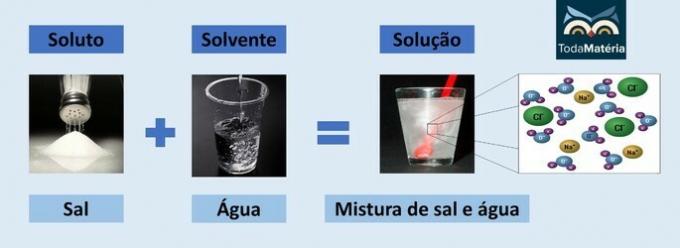
Exempel: Om du lägger socker i ett glas vatten kommer du att märka att sockret försvinner i vattnet.
Men om du fortsätter att tillsätta socker kommer du att upptäcka att det någon gång börjar samlas i botten av glaset.
Detta beror på att vattnet, som är lösningsmedlet, har nått sin gräns på löslighet och den maximala koncentrationen. Lösningsmedlet som finns kvar i behållarens botten och inte upplöses kallas bakgrundskropp.
Överskott av socker i botten av glaset löser sig inte och påverkar inte koncentrationen av lösningen. Dessutom gör sockret som deponeras i botten av glaset inte vattnet något sötare.
Klassificering av lösningar
Lösningar kan klassificeras efter mängden löst löst ämne. Således kan de vara av tre typer: mättade, omättade och övermättade.
- mättad lösning: Lösningen har nått gränsen för löslighetskoefficienten, det vill säga det finns en maximal mängd löst löst i lösningsmedlet vid en viss temperatur.
- omättad lösning: Mängden löst löst ämne har ännu inte nått löslighetskoefficienten. Detta innebär att mer löst ämne kan tillsättas.
- övermättad lösning: Det finns mer löst löst ämne än under normala förhållanden. I detta fall presenterar de en fällning.
Läs följande texter för att lära dig mer om lösningar.:
- Utspädning av lösningar
- Molalitet
- Molaritet
- Titrering
Koncentration av lösningar
Från lösningen och lösningsmedlet är det möjligt att beräkna koncentrationen av en lösning.
Gemensam koncentration definieras som förhållandet mellan massan av löst ämne upplöst i en given volym lösning.
Koncentrationsberäkning görs med följande formel:
Varelse,
Ç: Koncentration (g / l);
m: massa av löst ämne (g);
V: lösningsvolym (L).
Exempel:
(Faap) Beräkna koncentrationen, i g / L, av en vattenlösning av natriumnitrat innehållande 30 g salt i 400 ml lösning:
Upplösning:
Observera informationen om mängder löst och lösningsmedel. Det finns 30 g salt (löst) i 400 ml vattenlösning (lösningsmedel).
Volymen är dock i ml och vi måste omvandla den till L:
För att känna till koncentrationen måste du bara tillämpa formeln:
Med detta resultat nådde vi slutsatsen att när vi blandar 30 g salt med 400 ml vatten, kommer vi att få en lösning med en koncentration på 75 g / L.
För mer information om hur man beräknar den gemensamma koncentrationen kan dessa texter vara till hjälp.:
- Lösningskoncentration
- Övningar om gemensam koncentration