Enligt modellen för orbitaler skapad av Linus Pauling 1960, den kovalenta bindningen som bildar molekyler inträffar genom fusion eller interpenetration av ofullständiga orbitaler av de element som är inblandade i Länk. Således dras slutsatsen att om elementet har en ofullständig omloppsbana (med endast en elektron) kan det bara göra en kovalent bindning. Om den har två ofullständiga orbitaler kan den göra maximalt två anslutningar och så vidare.
Titta emellertid på atomorbitalerna i grundämnet kol, som har atomantalet lika med 6 (Z = 6):
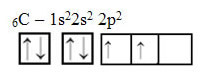
Observera att den har två ofullständiga orbitaler, så den ska bara utföra två bindningar högst. Men det är inte vad som händer med honom. Som många vet, bildar kol fyra bindningar (det är fyrvärde), så denna modell av orbitaler förklarar inte fallet med kol.
För att avsluta denna återvändsgränd skapades en ny teori som bättre förklarade denna fråga: Hybridiseringsteori.

Detta innebär att hybridisering är en "blandning" av rena orbitaler.
För kol finns det tre typer av hybridisering, vilka är: sp3, sp2 och sp.
För att förstå hur hybridisering sker, låt oss titta på den första typen av kolhybridisering, sp-typen.3:
Denna typ av hybridisering sker i metanmolekylen (CH4). Observera att det finns fyra identiska kovalenta bindningar mellan kol, som är det centrala elementet, och fyra väten. Så se vad den ofullständiga vätgasbanan är:
Eftersom varje väte har en ofullständig orbital av s-typ är det nödvändigt att ta emot ytterligare en elektron, det vill säga var och en gör endast en kovalent bindning med kolet. Det är därför som kol måste ha fyra ofullständiga orbitaler. Hur händer detta? Genom hybridisering.
När en elektron från 2s-banan absorberar energi, passerar den in i den tomma 2p-banan. Således säger vi att detta hopp av elektronen från 2s till 2p undernivå är en "befordran" av elektronen. På detta sätt förblir kolet i sitt exciterade eller aktiverade tillstånd, med fyra hybridiserade orbitaler tillgängliga för att utföra de kovalenta bindningarna:
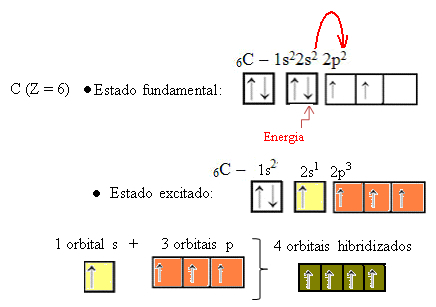
Observera att de bildade hybridorbitalerna är ekvivalenta med varandra, men skiljer sig från de ursprungliga rena orbitalerna.
På detta sätt uppträder bindningen mellan s-orbitalen för var och en av de fyra väteatomerna med dessa fyra hybridiserade kolorbitaler:
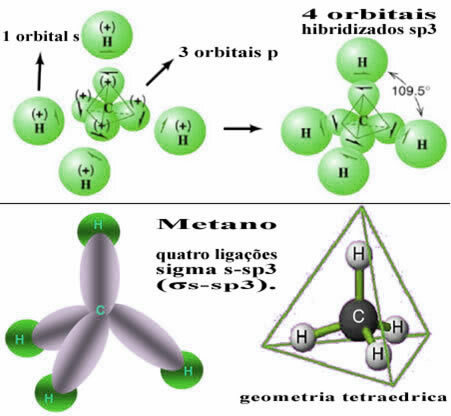
Som framgår ovan har metanmolekylen en regelbunden tetraederstruktur, med de fyra elektronmolnen vid varje toppunkt och intilliggande vinklar på 109 ° 28 '. Eftersom bindningen gjordes mellan en s-orbital av varje väte och en hybridiserad sp-orbital3 för varje anslutning, då har vi att de är fyra sigma s-sp-länkar3 (σs-sp3).
Av Jennifer Fogaça
Examen i kemi
Källa: Brazil School - https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp3.htm
