Redoxreaktioner involverar överföring av elektroner mellan atomer, joner eller molekyler.
I en oxidationsreduktionsreaktion inträffar förändringar i oxidationsnumret (nox). Oxireduktion består av oxidations- och reduktionsprocesserna:
- Oxidation: resulterar i elektronförlust och ökad nox.
- Minskning: resulterar i elektronförstärkning och minskat nox.
När ett element ger upp elektroner kommer ett annat att ta emot dem. Således är det totala antalet mottagna elektroner lika med det totala antalet förlorade elektroner.
Exempel på redoxreaktioner vid förbränning, korrosion och fotosyntes.
Exempel
Beroende på vilket element som tar emot eller donerar elektroner har vi följande namn:
- Reduktionsmedel: En som genomgår oxidation orsakar minskning och ökar dess noxantal. Det är det som tappar elektroner.
- Oxiderande medel: Den som genomgår reduktion, orsakar oxidation och minskar sitt nummerantal. Det är det som får elektroner.
O oxidationsnummer representerar den elektriska laddningen för ett element vid den tidpunkt det deltar i a kemisk bindning.
Detta tillstånd är relaterat till elektronnegativitet, vilket är tendensen hos vissa element att ta emot elektroner.
1. Observera det första exemplet, notera att i reaktionen mellan järn och klor sker en förändring av oxidationsnumret. O klor eftersom det är mer elektronegativ får det elektroner:
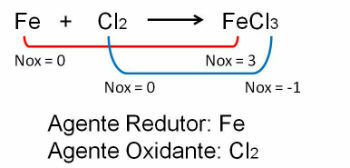
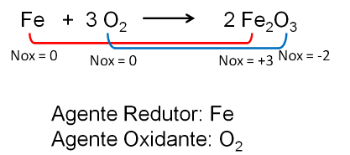
2. Reaktion mellan järn och syre. Syre är mer elektronegativt och slutar ta emot elektroner och minska deras oxidationsnummer.
Läs mer, läs även:
- Oxidation
- Förbränning
- Kemiska reaktioner
- elektroner
Övning löst
1. (PUC-RS) I förhållande till oxidationsekvationen - obalanserad reduktion Fe0 + CuSO4 → Fe2(ENDAST4)3 + Cu0, kan man säga att:
a) oxidationsantalet koppar i kopparsulfat är +1.
b) järnatom förlorar 2 elektroner.
c) koppar genomgår oxidation.
d) järn är ett oxidationsmedel.
e) järn genomgår oxidation.
Upplösning:
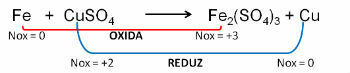
Svar:
e) järn genomgår oxidation.
Övningar
1. (UFAC-AC) I följande kemiska ekvation: Zn + 2 HCℓ → ZnCℓ2 + H2
a) elementet Zn oxiderar och reagerar som ett oxidationsmedel.
b) Zn-elementet oxiderar och reagerar som reduktionsmedel.
c) Zn-elementet reducerar och reagerar som reduktionsmedel.
d) HC2 är ett reduktionsmedel.
e) Ekvationen klassificeras som reversibel.
b) Zn-elementet oxiderar och reagerar som reduktionsmedel.
2. (ITA-SP) I den joniska reaktionen Ni (s) + Cu2+(aq) → Ni2+(aq) + Cu (s)
a) nickel är oxidationsmedel eftersom det oxideras.
b) nickel är reduceringsanordningen eftersom den oxideras.
c) kopparjonen är oxidationsmedel eftersom den oxideras.
d) kopparjonen är reduceringsanordningen eftersom den reduceras.
e) det är inte en redoxreaktion, därför finns det ingen oxidationsmedel eller reduktionsmedel.
b) nickel är reduceringsanordningen eftersom den oxideras.
3. (UFRGS) Det aktiva medlet i hushållsblekmedel är hypokloritjonen, ClO-. Vid blekningsprocesser reduceras denna jon; Detta innebär att:
a) ämnet som genomgår hypokloritverkan tar emot elektroner.
b) det finns en minskning av antalet elektroner i dess struktur.
c) ClO- är ett reduktionsmedel.
d) ClO- omvandlas till elementärt klor eller kloridjon.
e) ingen elektronöverföring sker.
d) ClO- omvandlas till elementärt klor eller kloridjon.



