Hybridisering av kol av sp-typ2 det inträffar när det har en dubbelbindning och två enkelbindningar eller en pi-bindning (π) och tre sigma-bindningar (σ). I själva verket sp hybridisering2 det åstadkommes mellan atomerna som etablerar dubbelbindningen.
Ett exempel på en sådan molekyl är formaldehyd (CH2O). Notera dess struktur nedan:
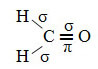
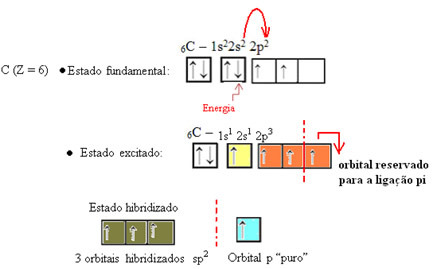
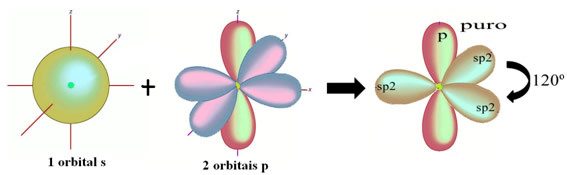
Som framgår av texten "sp-typ hybridisering3”, Koldioxidhybridisering inträffar när en elektron från undernivå 2s tar emot energi och” transporteras ”till 2p undernivå och därmed härstammar från 4 hybridiserade orbitaler från "blandningen" av atomorbitaler ren.
När det gäller formaldehyd vet vi att det kommer att finnas en pi-bindning, så en av dessa hybridiserade orbitaler är reserverad för denna bindning, medan de andra tre bär sigma-bindningarna:
Väteatomerna som bildar den enskilda bindningen med kol, gör den med sin orbital:
Återstående "rena" p-orbital dubbelbindar syreatomen och formaldehydmolekylen har följande struktur:
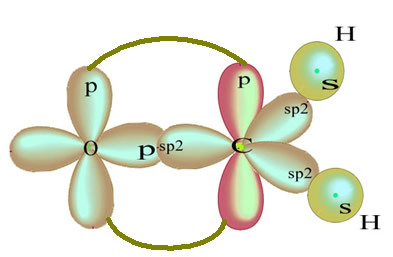
När det gäller typen av bindningar som finns i denna formaldehydstruktur har vi:

Anslutningar: 1 = 2 = σs-sp2
3 = σp-sp2
4 =πp-p
Av Jennifer Fogaça
Examen i kemi
Källa: Brazil School - https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp2.htm
