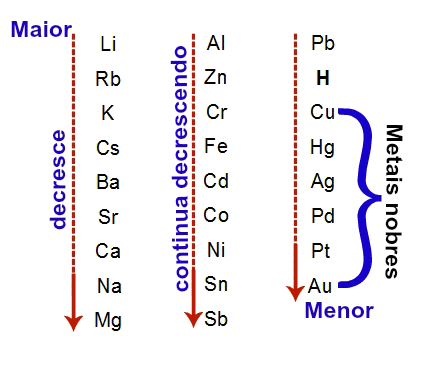
Ett av sätten att organiska element organiseras är genom familjer, som motsvarar de vertikala sekvenserna i det periodiska systemet.
På 18 kolumner i tabellen grupperar elementen efter likheter i kemiska egenskaper.
Att organisera kemiska element i familjer var ett praktiskt sätt att strukturera den information som hittades och presentera dem på ett enkelt sätt.
För att underlätta placeringen av ett kemiskt grundämne betecknades familjer i antal från 1 till 18 enligt följande:
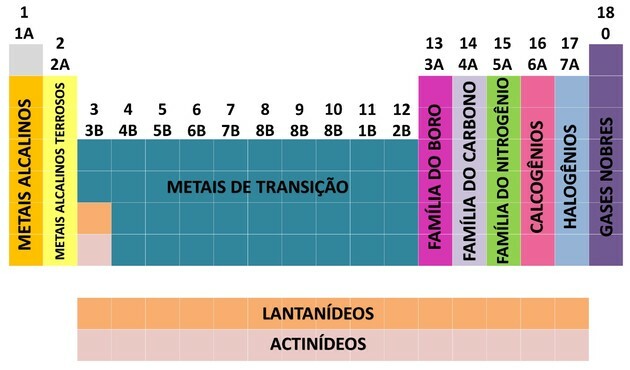
Genom bidrag från många forskare och olika försök att ordna data utvecklades det periodiska systemet och skapade en ordning för att ordna elementen.
Nomenklatur för familjer
- Familjerna i tabellen delades in i A (representativ) och B (övergång), identifierade med bokstäver och siffror.
- Du representativa element familjerna 0, 1A, 2A, 3A, 4A, 5A, 6A och 7A motsvarar.
- Du övergångselement familjerna 1B, 2B, 3B, 4B, 5B, 6B, 7B och 8B motsvarar.
- Genom beslut av International Union of Pure and Applied Chemistry (IUPAC) identifierades familjerna i grupper från 1 till 18.
Periodiskt system och elektronisk distribution
Likheterna mellan elementen i samma familj förekommer eftersom antalet valenselektroner i atomen i marktillståndet är detsamma för medlemmarna i en viss grupp.
Till exempel:
| Grupp 1 | Eletronisk distribution |
|---|---|
| 3läsa | 2-1 |
| 11På | 2-8-1 |
| 19K | 2-8-8-1 |
| 37Rb | 2-8-18-8-1 |
| 55Cs | 2-8-18-18-8-1 |
| 87Fr | 2-8-18-32-18-8-1 |
Grupp 1-atomer har sina elektroner fördelade över mer än en energinivå, men alla har en valenselektron.
Med det observerar vi att göra elektronisk distribution av atomen i marktillståndet hittar vi dess position på det periodiska systemet.
representativa element
Representativa element uppvisar relativt mindre komplext kemiskt beteende än övergångselement och bildar de flesta ämnen runt omkring oss.
Några av de representativa elementfamiljerna får speciella namn, som visas nedan:
Grupp |
Familj | specifikt namn | Namn ursprung | Element | elektronisk konfiguration |
|---|---|---|---|---|---|
| 1 | 1A | alkaliska metaller | från latin alkali, vilket betyder ”grått av växter”. | Li, Na, K, Rb, Cs och Fr | oss1 |
| 2 | 2A | alkaliska jordartsmetaller | Uttrycket "jordiskt" hänvisar till "existerande på jorden". | Var, Mg, Ca, Sr, Ba och Ra | oss2 |
| 13 | 3A | bor familj | Namnet på det första elementet i familjen. | B, Al, Ga, In, Tl och Nh. | oss2np1 |
| 14 | 4A | kolfamilj | Namnet på det första elementet i familjen. | C, Si, Ge, Sn, Pb och Fl. | oss2np2 |
| 15 | 5A | Kvävefamiljen | Namnet på det första elementet i familjen. | N, P, As, Sb, Bi och Mc. | oss2np3 |
| 16 | 6A | Chalcogens | från grekerna khalks, eftersom de är element som finns i kopparmalm. | O, S, Se, Te, Po och Lv. | oss2np4 |
| 17 | 7A | Halogener | Grekiskt uttryck som betyder saltbildare. | F, Cl, Br, I, At och Ts. | oss2np5 |
| 18 | 0 | Ädelgaser | Det ansågs inte reagera med andra ämnen. | Han, Ne, Ar, Kr, Xe, Re och Og. | 1s2 (Han) eller oss2np6 |
Genom tabellen kan vi se att:
- Elementen som presenteras ovan klassificeras som representativa eftersom de har den mest energiska elektronen i ett s- eller p-undernivå.
- Elektroner fördelas över energinivåer och n representerar atomens yttersta nivå i marktillståndet.
- De representativa elementen, enligt IUPAC: s rekommendation, tillhör grupperna eller familjerna 1,2,13,14,15,16,17 och 18.
O väte den klassificeras bortsett från de andra elementen. Även med 1s elektronisk konfiguration1, han är inte en del av grupp 1 för att presentera ett enskilt beteende.
övergångselement
Övergångselementen motsvarar grupperna 3 till 12. De får detta namn eftersom de har mellanliggande egenskaper mellan grupp 1 och 2 och de representativa icke-metalliska elementen.
Du övergångsmetaller definieras av IUPAC som:
Ett övergångselement har en ofullständig d-undernivå eller kan bilda katjoner med en ofullständig d-undernivå.
När den mest energiska elektronen i grundtillståndsatomen befinner sig i ett ofullständigt d-undernivå, kännetecknas det som en yttre övergång.
Lantanider och aktinider är interna övergångselement eftersom de har minst ett ofullständigt f undernivå.
När element har elektroner som fyller d- eller f-orbitalerna uppvisar de liknande egenskaper och kan klassificeras i d- eller f-orbitalelement. yttre eller inre övergång.
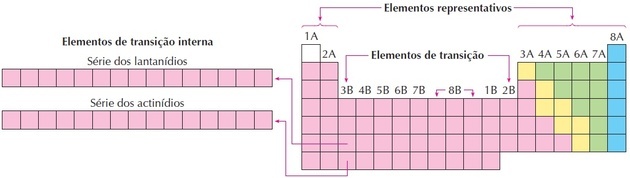
Som vi kan se i bilden motsvarar familj 8B tre kolumner, de är grupperna 8, 9 och 10, som grupperades så här eftersom de har liknande egenskaper.
Huvudegenskaper hos familjer
Tabellen nedan visar de viktigaste egenskaperna för grupperna i det periodiska systemet:
| Grupp | Funktioner | sammansatta ämnen vanligare |
händelser |
|---|---|---|---|
| 1 | Fast och glänsande under omgivande förhållanden. Mycket reaktiva, mjuka och bra ledare av el. | Salter, hydroxider och oxider |
Reagera med halogener och bilda salter. |
| 2 | Mindre reaktivt och svårare än grupp 1. Fastämnen i silver med god konduktivitet. | Salter, hydroxider och oxider |
Bildar salter och oxider. |
| 3 till 12 | De bildar komplex. De är metalliska fasta ämnen, hårda och spröda, med undantag av kvicksilver, som är en vätska. | Salter, oxider och komplex. Ex: AgNO3, TiO och [Cr (OH)3(H2O)3] |
I mineraler i form av oxider. |
| 13 | Torrsubstanser i omgivande förhållanden, silver, utom bor. | Oxider Ex: B2O3 |
I mineraler i form av oxider. |
| 14 | Fast i omgivande förhållanden. | Atomer av C och Si kan ordna sig i kedjor och producera ett stort antal ämnen. | I levande organismer och i form av silikater eller oxider. |
| 15 | Torrsubstanser, utom kväve, som är gasformigt under omgivande förhållanden. | Oxider och syror Ex: NEJ2 och H3DAMM4 |
Atmosfär, levande organismer och mineraler. |
| 16 | Torrsubstanser, utom syre, som är gasformiga under omgivande förhållanden. | Sulfider och oxider Ex: ZnS och SiO2 |
Atmosfär, levande organismer och mineraler. |
| 17 | De bildar diatomiska molekyler och är mycket reaktiva. De är dåliga ledare för el och värme. De är aggressiva mot levande varelser och miljön. | Syror och salter. Ex: HCl och KBr |
Finns i ämnen organiska och mineraliska. |
| 18 | De är mycket stabila och finns i form av gaser. | De bildar knappast sammansatta ämnen. | Gaser i atmosfären. |
Kemiska och fysiska egenskaper skiljer en familj från en annan. Som vi har sett är kemiska egenskaper relaterade till elektroner av valens, och genom dem samverkar en atom med en annan, som är ansvarig för det kemiska beteendet och kemiska bindningar bildas.
Elementens fysikaliska egenskaper i samma grupp kan variera beroende på atomnummer och massa.
Övningar
Nu när du vet lite mer om periodiska systemfamiljer, testa dina kunskaper och se vad du har lärt dig.
1) Tänk på följande utdrag ur det periodiska systemet.
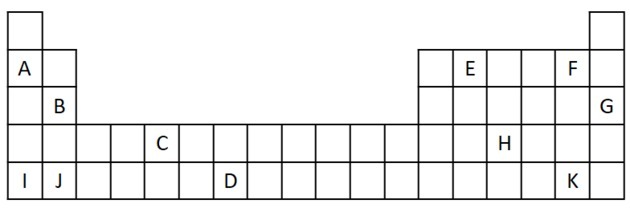
a) Namnge två element som har två valenselektroner.
b) Ange ett element som reagerar våldsamt med vatten och bildar en metallhydroxid.
c) Ange ett icke-reaktivt element.
d) Ange två element som kombineras med alkalimetaller för att bilda salter.
Svar:
a) B och J
Två valenselektroner motsvarar grupp 2, som har en ns-elektronkonfiguration2 och representeras i övningen av B och J.
b) A, B, I eller J.
A och I representerar delar av familj 1; B och J är från familj 2. Som vi såg i egenskaperstabellen är grupp 1 och 2 mycket reaktiva och kan bilda hydroxider, som i de givna exemplen: KOH och Mg (OH)2.
c) G
Ädelgaser är mycket stabila och därför inte särskilt reaktiva. Bokstaven G infogas i tabellen som en del av denna familj.
d) F och K
Halogener reagerar med alkalimetaller för att bilda salter. Det vanligaste exemplet på detta är bordssalt, NaCl.
2) Följande bild visar tre kemiska element, från vänster till höger, litium, natrium och kalium.

Välj det alternativ som korrekt kompletterar vart och ett av följande påståenden.
1.1) "Vi kan säga att litium, natrium och kalium ...
(A)... tillhör samma period. ”
(B)... har samma atomnummer. ”
(C)... tillhör samma grupp. ”
(D)... har samma massnummer. ”
1.2) "Elementen litium, natrium och kalium ...
(A)... har mycket liknande kemiska egenskaper. ”
(B)... har mycket olika kemiska egenskaper. ”
(C)... är icke-metaller. ”
(D)... reagera med vatten för att bilda sura lösningar. ”
Svar:
1.1) (C) tillhör samma grupp.
1.2) (A) har mycket liknande kemiska egenskaper.
Vi kan få denna information genom att gå igenom det periodiska systemet eller genom att göra den elektroniska distributionen av elementen litium, natrium och kalium. Vi kommer att se att de tre har en elektron i valensskalet och eftersom de ingår i samma grupp är de kemiska egenskaperna mycket lika.
3) Tänk på följande tabell, där atomnummer och elektroniska fördelningar av vissa kemiska element representeras.
| Element | kemisk symbol | atomnummer | Eletronisk distribution |
|---|---|---|---|
| Litium | läsa | 3 | 2,1 |
| Beryllium | vara | 4 | 2,2 |
| Fluor | F | 9 | 2,7 |
| neon | Huh | 10 | 2,8 |
| klor | Cl | 17 | 2,8,7 |
| argon | Luft | 18 | 2,8,8 |
| Kalium | K | 19 | 2,8,8,1 |
| Kalcium | Här | 20 | 2,8,8,2 |
Ange gruppen för varje element.
Svar:
Litium och kalium: grupp 1. (De har en elektron i valensskalet).
Beryllium och kalcium: grupp 2. (De har två elektroner i valensskalet).
Fluor och klor: grupp 17. (De har sju elektroner i valensskalet).
Neon och argon: grupp 18. (De har åtta elektroner i valensskalet).
Kontrollera antagningsfrågor med en kommenterad resolution i Övningar på det periodiska systemet och opublicerade frågor om ämnet i Övningar för att organisera det periodiska systemet.