Allotropi är ett fenomen som uppstår när samma kemiska element har egenskapen att bilda mer än en enkel substans.. Dessa allotropa sorter kan skilja sig åt på grund av antalet atomer i grundämnet som är bundna i en molekyl eller på grund av arrangemanget av atomer i kristallgitteret.
Ett av elementen som har allotropa sorter är fosfor (P), den vanligaste är vit fosfor det är röd fosfor. Dessa två fosforallotroper skiljer sig inte genom sitt olika rumsliga arrangemang, eftersom båda i grunden består av tetraedriska molekyler, men mängden fosforatomer är olika i var och en.
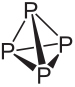
Se konstitutionen och huvudegenskaperna för vit och röd fosfor:
- Vit fosfor:
Molekylformeln för vit fosfor är P4, vilket innebär att dess molekyler består av fyra fosforatomer.

Denna typ av fosfor är extremt reaktiv, till stor del på grund av spänningen i 60 ° vinklarna mellan dess bindningar. Det är så reaktivt att det måste lagras i vatten så att det inte kommer i kontakt med luften och exploderar. Stor försiktighet måste iakttas vid hantering, eftersom det orsakar svåra hudbrännskador och förgiftning vid förtäring (endast 0,1 g intagen vit fosfor kan leda till döden).
Som du kan se nedan är vit fosfor ett vitt vaxliknande fast ämne.

Vit fosfor lagrad i vatten för att inte komma i kontakt med luft *
Vid uppvärmning i frånvaro av luft blir vit fosfor till röd fosfor.
- röd fosfor:
Röd fosfor har ingen bestämd struktur, men det finns bevis för att det är makromolekyler som bildas genom bindningen av de nämnda tetraedriska strukturerna (P4), representerad av PNej.
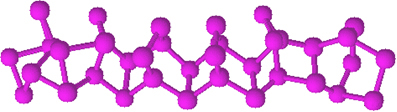
Det är mycket mindre reaktivt än vitt fosfor, men det kan antändas om det gnuggas. Därför används den på tändsticksaskarnas sidoytor. När vi gnuggar tandpetaren på lådans yta tänds tändstickan och antänds i sin tur det lättantändliga materialet på tandpetarens huvud.
I vissa länder placeras tändstickan på tandpetarens huvud i form av P.4s3.
Röd fosfor är ett amorft pulver, det vill säga det har ingen kristallstruktur och är mörkrött i färg, som visas nedan:

Rött fosforpulver.
* Bildförfattarskap tillhör W. Oelen och hon finns på här.
Av Jennifer Fogaça
Examen i kemi
Källa: Brazil School - https://brasilescola.uol.com.br/quimica/alotropia-fosforo.htm
