Vissa föreningar har i sin struktur dubbelbindningar alternerande med enkelbindningar. Den mest kända av dem alla är bensen, vars struktur föreslogs 1865 av den tyska kemisten Friedrich August Kekulé (1829-1896). Dess struktur skulle vara cyklisk och bildas av tre dubbelbindningar isär med tre enkelbindningar, som visas i figurerna nedan:
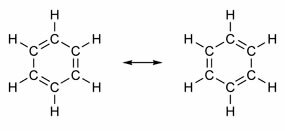
Båda sätten att representera bensen är acceptabla, eftersom det är möjligt att ändra elektronerna i π-bindningarna utan att ändra atomernas position. Men varken representerar exakt vad han är eller förklarar sitt beteende. Det ska bete sig som en alken och framkalla tillsatsreaktioner, men i praktiken händer det inte. Bensen är ganska stabil och fungerar som om den inte har dubbelbindningar; det ger substitutionsreaktioner som i alkaner.
1930 föreslog den amerikanska forskaren Linus Pauling resonansteorin som förklarade denna uppenbara motsägelse. Denna teori sa:
”Närhelst, i en strukturformel, kan vi ändra elektronernas position utan att ändra atomernas position , den verkliga strukturen Nej kommer inte att vara någon av de erhållna strukturerna, utan snarare en resonanshybrid av dessa strukturer. ”
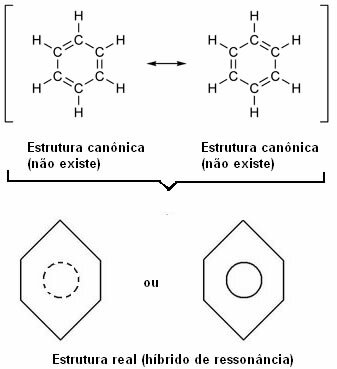
Denna effekt framgår av storleken på kolbindningarna och avståndet mellan dem. Detta avstånd är mellanliggande till det för enkelbindningen (1,54 Å) och det för dubbelbindningen (1,34 Å); är därför 1,39 Å på grund av resonanseffekten.
Denna effekt kan också ses i ozonmolekylens struktur (O3), enligt nedanstående:
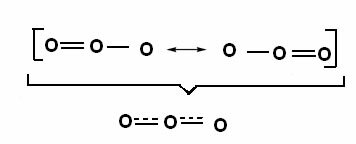
Kanoniska strukturer och ozonresonanshybrider.
Av Jennifer Fogaça
Examen i kemi
Brasilien skollag.
Källa: Brazil School - https://brasilescola.uol.com.br/quimica/ressonancia-compostosquimicos.htm

