Klorider är de jonföreningar som innehåller anjonen Cℓ-1.
Klor är av 17- eller 7A-familjen, dess atomnummer är lika med 17 och det har 7 elektroner i valensskalet (atomens yttersta elektronskal). Enligt regel av oktetten, För att vara stabil måste den ha 8 elektroner i det sista skalet och måste därför ta emot ytterligare en elektron. När detta händer, det vill säga när det tar emot en elektron i allmänhet från en jonbindning med en metall, bildas â.nionklorid (Cℓ-1) blir metallen som gav upp elektronen en katjon och det bildade ämnet är joniskt.
Klorider är salter härledda från reaktionen mellan en bas och saltsyra (HC2)(här)). Basen ger katjonen och saltsyra ger kloridjonen:
Generisk bas + saltsyra → Klorid + vatten
ÇOH + HCℓ → ÇCℓ + H2O
Klorider klassificeras alla som oorganiska salter, eftersom de i ett vattenhaltigt medium frisätter en annan katjon än H+ och släpp kloridanjonen, inte hydroxylen (OH-).
Kloridernas nomenklatur följer alltid denna regel: Klorid +de + (namnet på elementet kopplat till klor).
På dina formler är formade byta ut jonladdningarna mot indexen (nummer som finns längst ned till höger om elementets symbol, vilket anger antalet atomer för det element som finns som gör bindningar).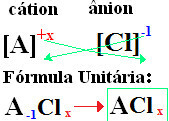
om indexet är "1", du behöver inte skriva det i formeln, som visas nedan:
På+1 Cℓ-1 → På1Cℓ1 → PåC2: natriumklorid;
K+1 Cℓ-1 → KC2: kaliumklorid;
Här+2 Cℓ-1→CaC32: kalciumklorid;
Ba+2 Cℓ-1→ Bhär2: bariumklorid;
Aℓ+3 Cℓ-1→ACℓ3: aluminiumklorid.
Som förklaras i texten “Joniska ämnen i gruppen: klorid, karbonat, nitrat och sulfat”, Som med alla joniska substanser, har klorider inte sina enhetliga formler isolerade i naturen, eftersom deras joner lockar varandra och bildar kristallgaller.
Det viktigaste exemplet på klorid som vi har i vårt dagliga liv är natriumklorid, NaC ^, bordssaltet. Se den jonbindning som resulterar i dess bildning (där natrium donerar en elektron till klor) och under kristallgitteret i detta salt:
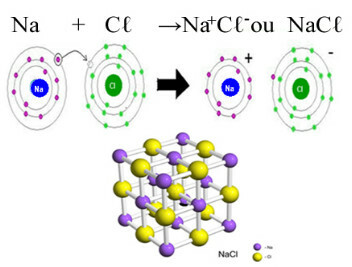
I det kristallina gitteret av natriumklorid varje anjon Cℓ- är omgiven av 6 katjoner Na+ och vice versa, så koordinationsnumret för detta kristallgitter är 6.
Alla klorider är fasta ämnen i omgivande förhållanden och ganska vattenlösliga, är bland de vanligaste salterna som finns i våra dagliga liv, med tanke på att flera av dem är närvarande lösta i mineralvatten, dricksvatten, kranvatten, floder, hav, bland andra. Bland undantagen, som är vattenolösliga klorider, är silverklorid (AgCℓ - visas i figuren nedan), från bly, koppar och kvicksilverföreningar.

Vattenolöslig silverklorid *
Cℓ-jonerna-1 från kloriderna vi intar, främst i salt, fisk och kött, är viktiga för vissa funktioner i människokroppen, eftersom de är den huvudsakliga extracellulära anjonen, som finns i juicen mag, reglera kroppsvätskor, såsom vattenfördelning i kroppen, och upprätthålla osmotiskt tryck och neutralitet i plasma elektrisk.
Dess brist kan orsaka ångest, diarré och cirkulationsproblem. Dess överskott utsöndras genom urin (i genomsnitt utsöndrar varje person cirka 4 g klorid per dag), svett och avföring.
*Bildkredit: Författare: Danny S. / Bild extraherad från: Wikimedia Commons
Av Jennifer Fogaça
Examen i kemi
