Kol är ett kemiskt grundämne med ett atomnummer (Z) lika med 6, vilket innebär att atomerna som bildar det har sex protoner i sin kärna. Dess molära massa är 12 011 g / mol och i naturen finns tre isotoper av kol, vilka är: o kol-12, kol-13 och kol-14. C-12 har sex protoner och sex neutroner i kärnan och är den vanligaste.
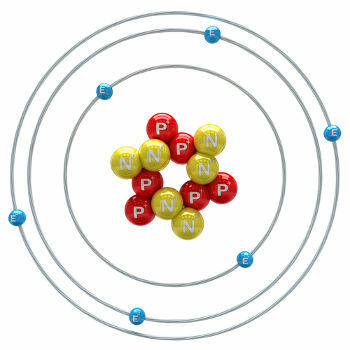
kolatom-12 illustration
C-13 har sju neutroner och är minst förekommande (1,01 till 1,14%). C-14 har åtta neutroner och är en radioaktivt element som avger β-partiklar (elektroner) som bildas i jordens stratosfär när kosmiska strålneutroner bombarderar kväve-14 som finns i dessa övre lager av atmosfären. Det införlivas av alla växter och djur och, med vetskap om att dess halveringstid är cirka 5730 år, används för att bestämma fossilåldern mellan 100 och 40 000 år. Mer information om C-14 och dateringstekniken kan ses i texten. Vad är Carbon-14?
Kol är fyrvärtigt, det vill säga det behöver ytterligare fyra protoner i sitt valensskikt (yttersta skiktet) för att lyda oktettregeln. Därför gör det vanligtvis fyra kovalenta bindningar, som delar fyra par elektroner med andra element såväl som andra kol. Dessa bindningar kan vara enkla, dubbla eller tredubbla och resultera i bildandet av miljontals olika föreningar. Av denna anledning skapades ett område för kemi,
Organisk kemi, som studerar huvudföreningarna härledda från kol, med undantag för vissa fall som är av mineraliskt ursprung, såsom koldioxid (CO2), O kolmonoxid (CO), O kalciumkarbonat (CaCO3), natriumvätekarbonat eller natriumbikarbonat (NaHCO3), mellan andra. Dessa föreningar studeras i Oorganisk kemi.Kol utför allotropi och bildar enkla ämnen, det vill säga ämnen som endast bildas av bindningar mellan kolatomer. Det finns minst sju allotroper av kol, som är grafit (alfa och beta), diamant, lonsdaleit (hexagonal diamant), chaoit, kol (VI) och fullerener. Det finns faktiskt flera typer av fullerener, som är syntetiska allotropa former av kol. De har en polyhedral struktur med en kolatom vid varje toppunkt och ett exempel är Ç60 kallad buckminsterfullereneoch dess struktur ser ut som en fotboll.
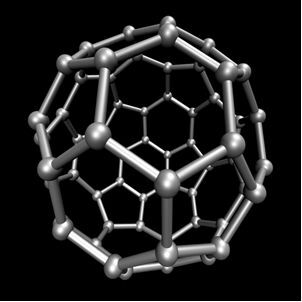
Kol-60 (buckminsterfullerene)
Men bland dessa allotroper av kol finns det bara två som är naturliga. grafitDet är från Diamant. De skiljer sig endast genom det kristallina arrangemanget av atomer i rymden, som visas i figuren nedan, och detta resulterar i helt olika fysikalisk-kemiska egenskaper. Läs texten kolototropi för mer information.

De två naturliga allotropa formerna av kol är grafit och diamant.
En annan syntetisk allotropisk form av kol är nanorör (bilden nedan) som har breda biologiska tillämpningar, inklusive medicinsk diagnostik och behandlingar.

Illustration av ett mikroskopiskt kolnanorör
Således, kol finns i allt omkring oss och inom oss, för att han komponerar naturliga organiska föreningar - såsom fossila bränslen, som inkluderar olja, kol och naturgas, och andra bränslen som etanol och biodrivmedel - bland annat jordbruksprodukter. form också syntetiska organiska föreningar, såsom syntetiska fibrer som utgör tyger, läkemedel, polymerer som utgör plast och gummi, insekticider, färgämnen och mycket mer. Inom oss, djur och grönsaker, bildar kol mycket viktiga föreningar, såsom kolhydrater, såsom socker, glukos och cellulosa; proteinerna som bildar till exempel DNA och tillsammans med lipider bildar membranen i röda blodkroppar och vita blodkroppar.
Allt detta visar vikten av kol för att upprätthålla livet. Men det har också förknippats med negativa aspekter, såsom intensifieringen av växthuseffekt och följden Global uppvärmning, detta beror på att den största skurken av dessa problem är dess koldioxidförening (CO2). Främst på grund av den stora förbränningen av fossila bränslen som släpper ut denna gas, koncentrationen av CO2 i atmosfären har ökat. Som växthusgas orsakar det de nämnda problemen. Å andra sidan är koldioxid också närvarande i vitala reaktioner såsom fotosyntes och andning.
Av Jennifer Fogaça
Examen i kemi
Källa: Brazil School - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-carbono.htm
