Kolväten, även kallad vätekarbider, är organiska föreningar vars sammansättning endast har atomer av kol (C) och från väte (H), så att den har den allmänna formeln CxHy.
Ett kolväte består av en kolstruktur till vilken väteatomer binds samman kovalent bindning.
Det är den viktigaste föreningen i organisk kemi.
Alla typer av kolväten oxiderar lätt och frigör därmed värme. De flesta av dem är inte vattenlösliga.
Naturliga kolväten är kemiska föreningar som bildas inuti jorden (mer än 150 km från djup) vid högt tryck och nå zoner med lägre tryck genom geologiska processer.
Var finns kolväten?
Den viktigaste källan till kolväte är olja. På grund av detta är kolväten närvarande i flera derivat såsom fotogen, paraffin, naturgas, Bensin, Vaselin, diesel olja, LPG (Gasol), polymerer (som plast och gummi), bland andra.
Denna organiska förening utgör 48% av Brasiliens energimatris.
Kolkedjan som utgör en del av sammansättningen av ett kolväte är tetravalentdet vill säga det kan göra fyra anslutningar.
Kol kan bindas med andra kolatomer och med väten genom enkla länkar, dubbel eller tripplar.
Klassificering av kolväten
Klassificeringen av kolväten baseras på tre specificiteter: a form av den huvudsakliga kolkedjan, den Anslutningar av kolkedjorna närvaro av alkylradikaler i kolkedjan och närvaro av heteroatomer dela kolkedjan.
veta mer om väte.
Huvudsaklig kolkedjeform
När det gäller formen på huvudkolkedjan är klassificeringen av kolväten indelad i alifatisk och cyklisk.
Kontrollera vad var och en av dessa former av kolkedja består av.
alifatiska kolväten
Alifatiska kolväten bildas av kolkedjor öppna eller acyklisk. I dessa kedjor är kol kol.
Exempel:
alkan
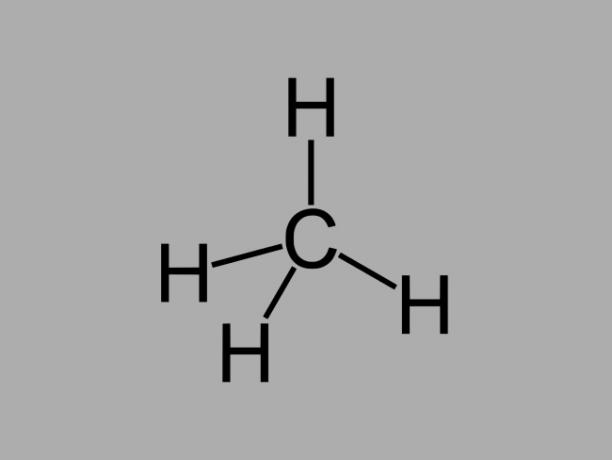
Alkankolväten, även kallad paraffiner eller paraffiniskär oljiga föreningar där det endast finns enstaka bindningar mellan kol.
Den allmänna formeln för en alkan är CNejH2Nej + 2 (n = valfritt heltal).
alken
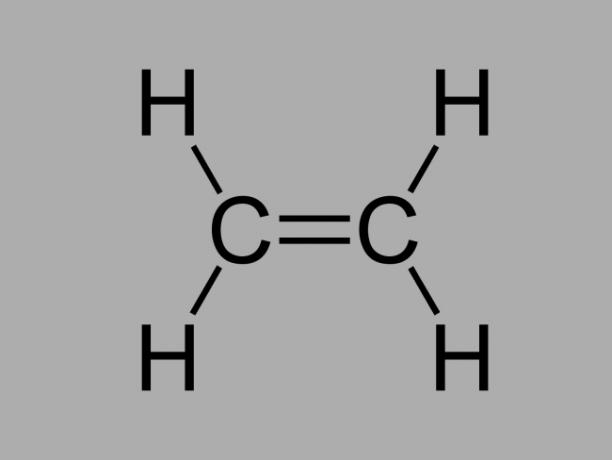
Även kallad olefin, alken eller etylenkolväte, alken är en dåligt reaktiv förening där det finns en dubbelbindning mellan kolerna.
Den allmänna formeln för en alken är CNejH2Nej.
alkyn
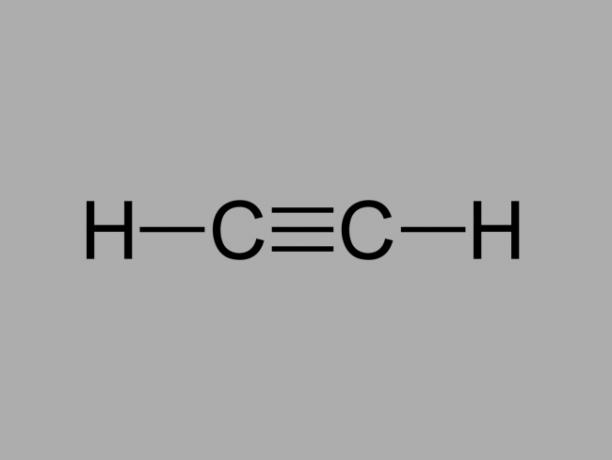
Även kallad metylacetylen, alkyn är ett kolväte där de befintliga bindningarna mellan kol är tredubbla.
Den allmänna formeln för en alkyn är CNejH2Nej-2.
alkadien

Även kallade diener eller diolefiner, alkadiener är kolväten där bindningarna mellan kol är dubbla.
Den allmänna formeln för en alkadien är CNejH2Nej-2.
Cykliska kolväten
Cykliska kolväten bildas av slutna eller cykliska kolkedjor. Dessa kedjor har inga terminala kol.
Exempel:
Cyclan
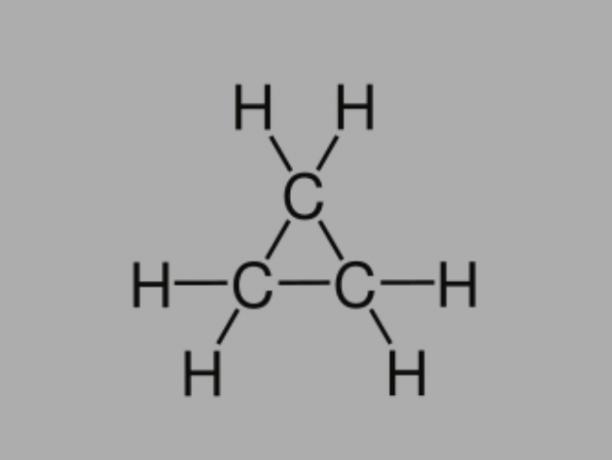
Även kallad cykloalkan, cykloparaffin eller nafteniskt kolväte, cyklan är ett mättat kolväte, som består av enkelbindningar.
Den har en sluten kolkedja och dess allmänna formel är CNejH2Nej.
Cyklonisk

Även kallad cykloalkenerär cyklener omättade kolväten, sammansatta av dubbelbindningar.
En cyklene har en sluten kolkedja och dess allmänna formel är CNejH2Nej−2.
cyklist
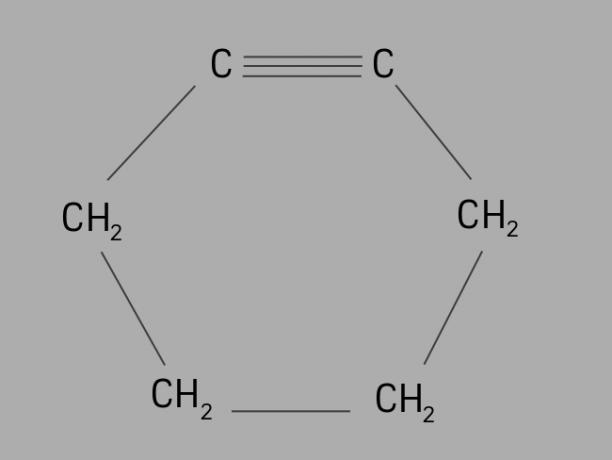
Även kallad cykloalkyne eller cykloalkyneär cyklin ett cykliskt och omättat kolväte.
Den bildas av en sluten kolkedja, med trippelbindningar och dess allmänna formel är CNejH2Nej-4.
Aromatisk

eller

Även kallad arenoraromatiska kolväten är omättade föreningar bildade av dubbelbindningar.
En aromat har en sluten eller cyklisk kolkedja och dess allmänna formel är C6H6.
Typ av bindning av kolkedjor
Beroende på typen av koppling av kolkedjorna kan kolväten klassificeras i mättad eller omättad.
Se nedan vad var och en av dessa klassificeringar består av.
Mättade kolväten
Mättade kolväten bildas av enkla länkar.
Exempel: alkaner, cyklaner.
omättade kolväten
Omättade kolväten bildas av dubbelbindningar eller tripplar.
Exempel: alkener, alkyner, alkadiener.
Förekomst av alkylradikaler
När det gäller närvaron av alkylradikaler kan kolväten ha en kolkedja vanligt eller grenad.
normal kolkedja
Ett normalt kolkedjekolväte har inte alkylradikaler.
Exempel: pentan
grenad kolkedja
När ett kolväte har en grenad kolkedja betyder det att dess huvudsakliga kolkedja har alkylradikaler.
Exempel: metylpropan
Förekomst av heteroatomer som delar kolkedjan
Den sekventiella kolkedjan kan delas upp eller inte beroende på närvaron av heteroatomer.
Homogen kolkedja
När ett kolväte har en homogen huvudkolkedja betyder det att denna kedja är inte uppdelad av heteroatomer.
Heterogen kolkedja
Om ett kolväte har en heterogen huvudkolkedja, hade denna kedja sin delad kolkedja av en heteroatom.
Nomenklatur för kolväten
Nomenklaturen för kolväten definieras genom en kombination av tre delar:

Prefixet identifierar mängden kol, mellanprodukten identifierar bindningstypen och suffixet indikerar funktionen som föreningen tillhör (i detta fall kolvätenklassen).
Se nedan för listan över prefix och mellanprodukter som kombineras för att beteckna kolväten.
Prefixlista
| Antal kol | Prefix |
|---|---|
| 1 | Träffade- |
| 2 | Et- |
| 3 | Stötta- |
| 4 | Men- |
| 5 | pent- |
| 6 | Hex- |
| 7 | Hept- |
| 8 | Okt- |
| 9 | Ej- |
| 10 | Dec- |
Förmedlarlista
| Kopplingstyp | Mellanhand |
|---|---|
| Bara enstaka samtal | -ett- |
| Par | -en- |
| trippel- | -i- |
| två par | -dien- |
Titta på några exempel på namngivning av kolväten.
Exempel:
CH3 - CH2 - CH2 - CH3
I den strukturella formen ovan kan vi se en 4-kolförening som endast har enstaka bindningar (indikerad med symbolen "-").
- Prefix för 4 kol = but-
- Mellanliggande för enkelbindning = -an-
- Suffix av ett kolväte = -o
Se att unionen av prefix + mellanliggande + suffix ger upphov till namnet BUTAN.
CH2 = CH2
Den strukturella formen ovan har två kolatomer och 1 dubbelbindning (indikeras med symbolen “=”).
- Prefix för 2 kol = et-
- Mellanliggande för dubbelbindningar = -en-
- Suffix av ett kolväte = -o
Se att unionen av prefix + mellanliggande + suffix ger upphov till namnet ETHENE.
CH2 = CH - CH2 - CH3
CH3 - CH = CH2 - CH3
Observera att båda ovanstående strukturformer har 4 kolatomer och 1 dubbelbindning (indikeras med "=" -symbolen).
Således har vi:
- Prefix för 4 kol = but-
- Mellanliggande för dubbelbindningar = -en-
- Suffix av ett kolväte = -o
Se att unionen av prefix + mellanliggande + suffix skulle ge upphov till namnet BUTENE för de två strukturformerna.
Observera dock att strukturformerna inte är identiska, så nomenklaturerna kan inte vara heller.
Skillnaden mellan de två strukturformerna ligger i placeringen av dubbelbindningen.
I det här fallet måste vi räkna kol i kedjan från slutet närmast dubbel. Därför måste vi numrera från vänster till höger i de aktuella fallen.
I CH2 = CH - CH2 - CH3:
- CH2 blir 1
- CH blir 2
- CH2 blir 3
- CH3 blir 4
Observera att dubbelbindning är mellan kol 1 det är kol 2.
Vi måste använda det minsta numret (1) för att hitta dubbelbindningen: BUTENE -1
I CH3 - CH = CH2 - CH3:
- CH3 blir 1
- CH blir 2
- CH2 blir 3
- CH3 blir 4
Observera att dubbelbindningen är mellan kol 2 det är kol 3.
Vi måste använda det minsta antalet (2) för att hitta dubbelbindningen: BUTENE -2
Enligt IUPAC (International Union of Pure and Applied Chemistry - International Union of Pure and Applied Chemistry), bör platsen anges något före lokaliseras (i fallet med strukturformalerna ovan, dubbelbindningen, representerad av mellanprodukten “-En-”).
Med det har vi ett andra sätt, som förresten är det mest korrekta, att skriva nomenklaturen för de tillgängliga strukturformerna.
CH2 = CH - CH2 - CH3: BUTENE -1 eller BUT-1-ENO (mer korrekt form)
CH3 - CH = CH2 - CH3: BUTENE -2 eller BUT-2-ENE (mer korrekt form)
Lära sig mer om IUPAC och nomenklatur.