Koktemperaturen för organiska föreningar påverkas av två faktorer: typen av intermolekylär interaktion och molekylens storlek.
Ju större molekylens storlek är, desto högre är dess koktemperatur.
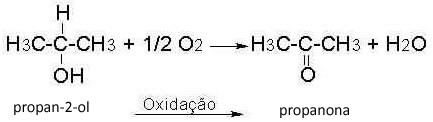
Observera strukturerna och deras respektive T.E .: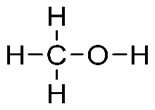 DU. (° C): 64,5
DU. (° C): 64,5
Metanol
 DU. (° C): 78,3
DU. (° C): 78,3
Etanol
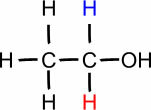
 DU. (° C): 97,2
DU. (° C): 97,2
Propanol
Observera att när molekylen ökar antalet kol, blir kokpunkten högre. Således kokar metanol som bara har en kolatom vid 64,5 ° C och Propanol (3 kol) når bara sin T.E. vid 97,2 ° C.
Men i molekyler av samma storlek? Hur man vet vilken som har T.E. högre?
Vilken typ av intermolekylär interaktion som kommer att avgöra.
Exempel: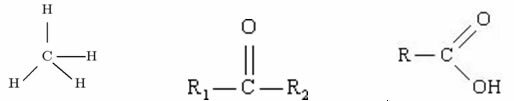
Metanketonkarboxylsyra
Bland dessa tre organiska strukturer, vilken har den högsta T.E.?
I det här fallet kan vi inte lita på molekylens storlek som vi gjorde tidigare, eftersom de tre strukturerna inte skiljer sig åt i detta avseende.
Regeln som nu gäller är: Ju högre intensitet de intermolekylära krafterna är, desto högre koktemperatur.
Inducerad dipol
Stigande intensitetsordning
→
Baserat på denna intensitetsskala, se vilka krafter som dominerar i molekylerna av:
Metan: dipolinducerad
Keton: dipol-dipol
Karboxylsyra: vätebindningar
Med detta kan vi klassificera vilken av dessa molekyler som har den högsta koktemperaturen: syran karboxylsyra har en högre T.E. eftersom vätebindningen i denna förening har störst intensitet.
Metan
Stigande intensitetsordning →
Detta schema visar att metan har den lägsta kokpunkten på grund av den dominerande typen av intermolekylär kraft (inducerad dipol).
Av Líria Alves
Examen i kemi
Brasilien skollag
Sluta inte nu... Det finns mer efter reklam;)
Se mer!
Polariteten hos organiska föreningar
Organisk kemi - Kemi - Brasilien skola
Vill du hänvisa till texten i en skola eller ett akademiskt arbete? Se:
SOUZA, Líria Alves de. "Koktemperatur för organiska föreningar"; Brasilien skola. Tillgänglig i: https://brasilescola.uol.com.br/quimica/temperatura-ebulicao-dos-compostos-organicos.htm. Åtkomst den 28 juni 2021.