DE Kemisk kinetik är ett fält som studerar de faktorer som påverkar utvecklingshastigheten för kemiska reaktioner, det vill säga den hastighet med vilken de äger rum. Det finns mer och mer forskning kring detta område, eftersom vi ofta vill påskynda vissa reaktioner eller sakta ner andra. Detta är särskilt viktigt för industrier och denna forskning har viktiga tekniska konsekvenser.
Men eftersom reaktionshastigheten kan variera vid varje tidsintervall och från ett ämne till ett annat är det vanligt att beräkna genomsnittlig reaktionshastighet.
Tänk på följande generiska reaktion, där koefficienterna är små bokstäver och reaktanterna och produkterna representeras av stora bokstäver:
a A + b B → c C + d D
Medelhastigheten för denna reaktion ges dela den genomsnittliga reaktionshastigheten för någon av de reagerande substanserna eller den genomsnittliga bildningshastigheten för någon av produkterna med dess respektive koefficient i den kemiska ekvationen. Detta ges av:
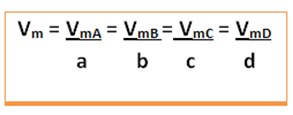
Tänk till exempel på väteperoxidnedbrytningsreaktionen:
2 timmar2O2 (aq) → 2 H2O(1) + 1 O2 (g)
Låt oss säga att på 1 minut bildades 0,3 mol / L H2O och 0,15 mol / L O2, medan 0,3 mol / L H sönderdelades2O2det vill säga de genomsnittliga nedbrytningshastigheterna och bildningen av dessa ämnen i reaktionen är:
VmH2O2 = 0,3 mol / l. min
VmH2O = 0,3 mol / l. min
VmO2 = 0,15 mol / l. min
Medelhastigheten för den globala reaktionen kommer att hittas genom att ta ett av dessa värden och dela det med respektive koefficient i ekvationen:
Vm = VmH2O2 = 0,3 mol / l. min = 0,15 mol / l. min
2 2
Vm = VmH2O = 0,3 mol / l. min = 0,15 mol / l. min
2 2
Vm = VmO2 = 0,15 mol / l. min = 0,15 mol / l. min
1 1
Observera att de tre värdena är lika, därför är reaktionshastigheten densamma som en funktion av vilken reaktant eller produkt som helst, inom samma tidsintervall.
Hur hittades dock värdena för medelhastigheterna för var och en av de ämnen som är involverade i dessa reaktioner?
Det kan beräknas dividera variationen i ämnets koncentration (reagens eller produkt) med tidsintervallet. Om vi ska bestämma medelhastigheten för en av reagens av reaktionen måste vi sätta en negativt tecken före eller annars överväga koncentrationsvärdet i modul ||, eftersom koncentrationen av reaktanten minskar över tiden skulle hastighetsvärdet vara negativt, men det finns ingen negativ hastighet.
Sluta inte nu... Det finns mer efter reklam;)

Tänk till exempel följande ozongasnedbrytningsreaktion (O3 (g)) i syrgas (O2 (g)):
2 O3 (g) → 3 O2 (g)
Låt oss säga att det i en ballong fanns 10 mol ozongas, men efter 1 minut var det bara 4 mol kvar; detta innebär att 6 mol ozon förvandlades till syrgas. Så vi har:
2 O3 (g) → 3 O2 (g)
t = 0 min 2 mol / L 0 mol / L
bildade utgifter
6 mol / L 9 mol / L.
t = 1 min 4 mol / L 9 mol / L
Observera att eftersom reaktionsförhållandet är 2: 3, användes då 6 mol O39 mol O bildades2. Så efter 1 minut har vi följande genomsnittliga hastigheter:
Vm = - ∆ [The3]
t
Vm = - ([O3final - O3 initial])
tSlutlig - tförsta
Vm = - ([4 - 10])
1– 0
Vm = 6 mol / L. min→ I 1 minut reagerade 6 mol ozon i varje liter i systemet.
Vm = ∆ [The2]
t
Vm = ([O2final - O2 initial])
tSlutlig - tförsta
Vm = ([9 - 0])
1– 0
Vm = 9 mol / L. min→ Under 1 minut bildades 9 mol syre i varje liter i systemet.
Detta visar oss att vi kan beräkna medelhastigheten som en funktion av reaktanterna eller som en funktion av produkterna.
Om vi nu vill beräkna medelhastigheten för denna globala reaktion, gör bara som vi visade i början: dela var och en av dessa hastigheter med sina respektive koefficienter i den kemiska ekvationen:
Vm = VmO3 = 6 mol / L. min = 3 mol / L. min
2 21
Vm = VmO2 = 9 mol / L. min = 3 mol / L. min
3 3
Vm = VmO3 = VmO2
23
Av Jennifer Fogaça
Examen i kemi
Vill du hänvisa till texten i ett skola eller akademiskt arbete? Se:
FOGAÇA, Jennifer Rocha Vargas. "Kemiska reaktioners hastighet"; Brasilien skola. Tillgänglig i: https://brasilescola.uol.com.br/quimica/velocidade-das-reacoes-quimicas.htm. Åtkomst den 27 juni 2021.


